Ostatnia aktualizacja 28 lipca 2022
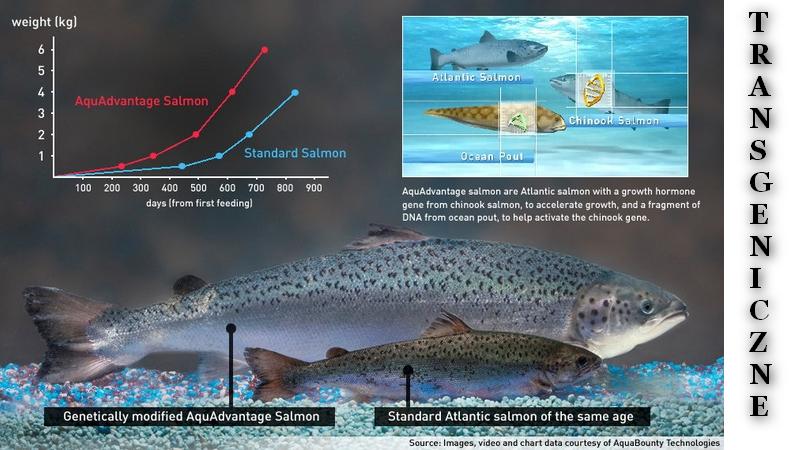
Amerykańska Agencja ds. Żywności i Leków (FDA) dopuściła w listopadzie 2015 roku do produkcji, sprzedaży i konsumpcji genetycznie zmodyfikowanego łososia atlantyckiego AquAdvantage, który charakteryzuje się szybszym tempem wzrostu i lepszym wykorzystaniem paszy niż jego niezmodyfikowany odpowiednik. Łosoś AquAdvantage jest tożsamy z łososiem atlantyckim scharakteryzowanym przez FDA w „Referencyjnej encyklopedii ryb”. W ramach przeprowadzonej oceny bezpieczeństwa stwierdzono, że profil odżywczy obu łososi jest porównywalny. Przedstawiono zasady znakowania produktów zmodyfikowanych genetycznie oraz postawy konsumentów wobec żywności zmodyfikowanej genetycznie. Uwzględniono również zdrowie i dobrostan transgenicznych zwierząt gospodarskich. Konieczny jest rozwój odpowiednich narzędzi do oceny ryzyka zdrowotnego oraz prowadzenie dalszych, bardziej pogłębionych badań dotyczących wpływu na zdrowie oraz oddziaływania na środowisko. Istnieje potrzeba upowszechniania wiedzy o żywności zmodyfikowanej genetycznie, która z pewnością będzie towarzyszyć postępowi metodologicznemu i wyznaczaniu celów mających realne zastosowanie w praktyce. Jest to szczególnie istotne w kontekście postaw społeczeństwa wobec organizmów genetycznie zmodyfikowanych (GMO).
Rozwój inżynierii genetycznej w ostatnich 35 latach pozwolił naukowcom na opracowanie genetycznie zmodyfikowanych zwierząt. W obecnej chwili zwierzęta transgeniczne wykorzystywane są głównie w medycynie jako modele w badaniu chorób człowieka. W przypadku transgenezy zwierząt gospodarskich postęp jest wolniejszy. Zdecydowana większość zwierząt transgenicznych znajduje się dopiero na etapie badań. Jednak możliwe, że niektóre z nich – obok łososia atlantyckiego AquAdvantage – w niedalekiej przyszłości będą dostępne na rynku. Zmodyfikowano wiele gatunków zwierząt gospodarskich, głównie z zamiarem poprawy ważnych gospodarczo cech, takich jak: szybkość wzrostu, jakość mięsa, skład mleka, odporność na choroby i przeżywalność . Świnie były doskonalone w kierunku szybszego wzrostu i wytwarzania większej ilości mięsa z jednoczesnym mniejszym zapotrzebowaniem na paszę. Udoskonalono również skład wieprzowiny. Naukowcy zwrócili szczególną uwagę na zdrowie świń, wzrost wskaźników przeżywalności prosiąt, zmniejszenie ryzyka chorób zakaźnych i wzmocnienie ich systemu immunologicznego. Celem modyfikacji owiec była poprawa produkcji wełny i poprawa odporności oraz zmniejszenie ryzyka śmiertelności po infekcjach bakteryjnych i wirusowych. Zwiększenie tempa wzrostu kurcząt zostało osiągnięte połowicznie, ponieważ już ukierunkowana intensywna selekcja wpłynęła na maksymalną poprawę tej cechy. Niemniej jednak zwiększono odporność na choroby (m.in. wirus H5N1) i wskaźnik przeżycia nowo wyklutych piskląt. W przypadku bydła skupiono się na zdrowiu wymion krów i przeżywalności cieląt. Wyhodowano także krowy GM odporne na BSE. Podobnie w przypadku ryb, szczególnie łososia, karpia czy tilapii, skupiono się na jakości i produkcji mięsa oraz odporności na choroby.
Pierwszej udanej transformacji genetycznej myszy laboratoryjnej dokonali w 1980 roku Gordon i wsp. Wkrótce za pomocą tej samej metody mikroiniekcji obcego DNA do przedjądrzy zygoty zostały po raz pierwszy otrzymane transgeniczne zwierzęta gospodarskie. Ze względu na to, że mikroiniekcja ma kilka istotnych wad, w tym przypadkową integrację z genomem gospodarza, niską wydajność i częstość występowania mozaikowatości, badania koncentrowały się na alternatywnych, ulepszonych metodach otrzymywania zwierząt transgenicznych. Przykładem tego jest ukierunkowana transformacja owcy (delecja genu białka prionowego) dokona przez brytyjskich badaczy z Instytutu w Roslin, którzy wcześniej sklonowali owcę (Dolly) metodą transplantacji jąder komórek somatycznych. Niemniej wprowadzanie nowych odmian roślin i naturalne doskonalenie genetyczne zwierząt jest wciąż możliwe dzięki tradycyjnym metodom hodowli, takim jak np. selekcja.
Celem pracy było przedstawienie modyfikacji składu chemicznego i wartości odżywczej mleka oraz cech wartości rzeźnej i jakości mięsa oraz tłuszczu zwierzęcego. Ponadto omówiono kwestie bezpieczeństwa żywności pochodzącej z łososia AquAdvantage oraz postawy konsumentów wobec żywności zmodyfikowanej genetycznie, a także zagadnienia związane ze zdrowiem i dobrostanem transgenicznych zwierząt gospodarskich.
Metody otrzymywania zwierząt transgenicznych
W zależności od gatunku do wytwarzania transgenicznych zwierząt, poza wspomnianą wyżej metodą, można zastosować jedną z poniższych:
a) transfer DNA za pośrednictwem lentiwirusa. Obce geny wprowadza się do wektorów zawierających naturalne elementy wspierające integrację DNA, np. lentiwirusów. Udoskonalona metoda mikroiniekcji DNA stała się rutynową procedurą laboratoryjną stosowaną powszechnie do hodowli transgenicznego bydła, owiec, świń, kóz oraz królików. Do niedawna transgeniczny drób był produkowany jedynie z wykorzystaniem retro- lub lentiwirusów. Ostatnio użycie macierzystych komórek zarodkowych pozwoliło na wytwarzanie transgenicznych kurcząt bez stosowania wektorów wirusowych;
b) transfer DNA za pośrednictwem plemników (ICSI, ang. Intracytoplasmic sperm injection). Plemniki inkubuje się z obcym genem i wstrzykuje do cytoplazmy oocytów w celu zapłodnienia. Metoda została opracowana głównie do otrzymywaniatransgenicznych świń i myszy;
c) przeniesienie DNA za pomocą komórek pluripotencjalnych. Przeniesienie obcego genu do komórek pluripotencjalnych (embrionalne komórki macierzyste ES lub pierwotne komórki płciowe EG) do zarodków we wczesnych fazach rozwoju w celu otrzymania chimerowych zwierząt mających normalne i transformowane komórki. Ta metoda jest pracochłonna i w praktyce zasadniczo ma zastosowanie do inaktywacji genów;
d) transfer DNA za pośrednictwem klonowania. Obcy gen wprowadza się do komórek somatycznych, których jądra są wprowadzane do cytoplazmy komórek jajowych pozbawionych jąder w celu wytworzenia transgenicznych klonów. Technika klonowania użyta do otrzymania owcy Dolly jest stosowana do otrzymywania transgenicznych przeżuwaczy i świń. Technika ta pozwala na dodanie genu lub wyciszenie jego ekspresji .
Transgeniczne zwierzęta mają szerokie zastosowanie do poprawy jakości produkcji zwierzęcej, zwiększenia mocy produkcyjnych, w modelach do badania chorób ludzkich i produkcji materiałów biomedycznych. Należy jednak podkreślić, że wykorzystanie transgenicznych zwierząt w rolnictwie jest dużo mniejsze niż w biomedycynie.
Modyfikacje składu chemicznego i wartości odżywczej mleka
Jednym z głównych celów modyfikacji genetycznych jest poprawa właściwości fizykochemicznych mleka, w tym udziału poszczególnych frakcji kazeiny. Przez nadmierną ekspresję β- i κ-kazeiny zwiększono ilość kazeiny bydlęcej, co wyraźnie poprawiło właściwości funkcjonalne mleka krowiego. Nie wyklucza się również wyprodukowania “hipoalergicznego” mleka poprzez knockout lub knockdown genu β-laktoglobuliny. W celu uzyskania mleka pozbawionego laktozy możliwa jest modyfikacja przez knockout lub knockdown genu α-laktoalbuminy, który jest kluczowy w syntezie cząsteczek cukru mlecznego. Może będzie można produkować mleko dla niemowląt, w którym obecna będzie ludzka laktoferyna lub mleko o zwiększonym standardzie higienicznym poprzez zwiększenie zawartości lizozymu. Uzyskanie mleka o zmniejszonej zawartości laktozy (lub bez niej) umożliwiłoby spożywanie nabiału ludziom dorosłym, którzy nie mają aktywnego enzymu laktazy jelitowej. Pamiętać jednak należy, że laktoza jest odpowiedzialna za potencjał osmotyczny mleka. Jego obniżenie może zakłócać wydzielanie mleka. W przypadku hemizygotycznych myszy udało się zredukować zawartość laktozy od 50 do 85 % bez wpływu na wydzielanie mleka . Jednakże homozygotyczne myszy z nokautem genu α-laktoalbuminy nie mogły karmić swojego potomstwa ze względu na zbyt wysoką lepkość mleka.
W przypadku świń transgeniczna ekspresja konstruktu bydlęcej laktoalbuminy w mleku maciory spowodowała zwiększenie zawartości laktozy i wzrost produkcji mleka, co było skorelowane ze zwiększoną przeżywalnością i szybszym rozwojem warchlaków.
Modyfikacje związane z cechami wartości rzeźnej i jakości mięsa oraz tłuszczu
W wyniku modyfikacji genetycznych uzyskano transgeniczne świnie z ludzkim insulinopodobnym czynnikiem wzrostu (IGF-1), charakteryzujące się większą masą schabu i polędwicy (odpowiednio: o 30 i 10 %) i zawierające przy tym 20 % mniej tłuszczu całkowitego w tuszy. Transgeniczne świnie miały także mniej beztłuszczowej masy ciała w porównaniu ze świniami kontrolnymi. Nadekspresja hormonu wzrostu (GH) świń spowodowała, że zwierzęta miały mniej tłuszczu ogółem, mniej nasyconych kwasów tłuszczowych, jak również mniej jedno- i wielonienasyconych kwasów tłuszczowych. Efekt ten uwidocznił się, gdy zwierzęta podrosły. Wzrost zawartości chudego mięsa doprowadził do zmniejszenia zawartości tłuszczu ogółem. Ze względu jednak na obecny brak akceptacji społecznej żywności zmodyfikowanej genetycznie, wprowadzenie tego typu produktów na rynek nie jest na razie możliwe.
Oprócz zwiększenia ogólnej masy mięśniowej, manipulacja składem tłuszczu mięśniowego to kolejny kierunek związany z inżynierią genetyczną. Konsumenci stają się coraz bardziej świadomi ilości i rodzaju spożytego tłuszczu w diecie, stąd trend w kierunku zmniejszenia spożycia tłuszczów nasyconych i zwiększenia spożycia tłuszczów nienasyconych.
W przeciwieństwie do ryb, ssaki nie potrafią przekształcić kwasów tłuszczowych omega-6 w omega-3, dlatego też pobierają kwasy tłuszczowe omega-3 z diety. W 2004 roku gen desaturazy kwasu tłuszczowego omega-3 z Caenorhabditis elegans (FAT-1) wprowadzono do organizmu myszy. Pozwoliło to na konwersję kwasów omega-6 do omega-3 przy braku kwasów omega-3 w diecie.
Ważnym krokiem w kierunku produkcji wieprzowiny o wyższych walorach zdrowotnych było uzyskanie pierwszej transgenicznej świni z genem desaturazy ze szpinaku lub Caenorhabditis elegans, który warunkuje zwiększoną produkcję nienasyconych kwasów tłuszczowych. W tkance tłuszczowej świń z genem desaturazy ze szpinaku zaobserwowano o 20 % większą zawartość kwasu linolowego niż w tkance świń dzikiego typu.
W przypadku świń transgenicznych z ekspresją ludzkiego genu FAT-1 zaobserwowano wzrost poziomu kwasów tłuszczowych omega-3 w ich mięśniach. Transgeniczne świnie z ekspresją genu FAT-1 pochodzącego od nicieni cechowało obniżenie stosunku kwasów omega-6 do omega-3 w mięśniach. Zhou i wsp. potwierdzili wcześniejsze wyniki. Nadekspresja genu FAT-1 z innych gatunków nicieni u transgenicznych świń wpłynęła na wzbogacenie mięsa w wielonienasycone kwasy tłuszczowe omega-3. Podobne wyniki uzyskano z nadekspresją genu FAT-1 w przypadku bydła i owiec. Zawartość tłuszczu śródmięśniowego myszy z nadekspresją DGAT1 wzrasta znacząco, głównie poprzez zwiększenie stężenia triacylogliceroli. Badania te wskazują na możliwość zwiększenia zawartości tłuszczu śródmięśniowego w tkankach zwierząt o wysokiej mięsności w celu poprawy jakości mięsa. Z kolei nadekspresja IL-15 hamuje odkładanie tkanki tłuszczowej w organizmie myszy, wpływając tym samym na skład tuszki. PPARγ2 reguluje różnicowanie adipocytów i magazynowanie tłuszczu. Myszy transgeniczne z nadekspresją PPARγ2 wykazywały zwiększoną zawartość triacylogliceroli i wzrost zawartości wielonienasyconych kwasów tłuszczowych. Obecnie trwają badania dotyczące transgenicznych owiec oraz świń z nadekspresją PPARγ.
Modyfikowany genetycznie łosoś atlantycki AquAdvantage
Spośród wielu gatunków ryb z wytworzoną nadekspresją genu GH najbardziej obiecujące wyniki uzyskano w przypadku łososia atlantyckiego AquAdvantage, którego amerykańska Agencja ds. Żywności i Leków (FDA) dopuściła w listopadzie 2015 roku do produkcji, sprzedaży i konsumpcji. AquAdvantage to triploidalna, hemizygotyczna samica łososia atlantyckiego (Salmo salar L.) wyposażona w jedną kopię α-postaci opAFP-GHc2 rekombinowanego konstruktu DNA wbudowanego w α-locus w linii EO-1α. Łosoś AquAdvantage został genetycznie zmodyfikowany w kierunku szybszego wzrostu niż jego niemodyfikowany odpowiednik. Jest to możliwe, ponieważ zawiera konstrukt rDNA, który składa się z genu hormonu wzrostu z łososia pacyficznego – czawyczy pod kontrolą promotora (sekwencji DNA, która zmienia ekspresję genu) od węgorzycy amerykańskiej (Zoarces americanus), dzięki czemu hormon wzrostu produkowany jest stale, a nie, jak u zwykłego łososia szlachetnego, tylko na wiosnę i w lecie. Pozwala to łososiowi wzrosnąć do wielkości rynkowej znacznie szybciej. Skrócono okres hodowli z 36 do 16 ÷ 28 miesięcy.
Jak wynika z badań Ganga i wsp., transgeniczny łosoś atlantycki (Salmo salar L.) ma zdolność do utrzymania przyspieszonego wzrostu, nawet gdy jest karmiony paszą o dużej zawartości białka roślinnego (68 %), jednocześnie z niższym poziomem białka zwierzęcego zawartego w mączce rybnej. Wynika z tego, że transgeniczne łososie atlantyckie (Salmo salar L.) charakteryzują się nie tylko szybszym tempem wzrostu i lepszym wykorzystaniem paszy niż ich niemodyfikowane odpowiedniki, ale również mogą utrzymać podobną lub lepszą wydajność przy obecności 68 % białka roślinnego w diecie, pochodzącego z relatywnie tańszych źródeł. Z kolei Oakes i wsp. wskazują, że transgeniczne łososie (Oncorhynchus kisutch) charakteryzują się nie tylko szybszym wzrostem oraz większym spożyciem paszy niż łososie nietransgeniczne, ale także lepszym wykorzystaniem białka, jak również tańszych niebiałkowych źródeł energii, głównie lipidów lub węglowodanów, w celu pokrycia większego dziennego zapotrzebowania na energię, co może wpłynąć na zmniejszenie kosztów produkcji.
W badaniach Tibbettsa i wsp. transgeniczny łosoś (Salmo salar L.) spożywał dziennie znacznie więcej paszy, ale ze względu na zwiększone tempo wzrostu, lepsze współczynniki konwersji paszy i wyższą efektywność retencji azotu mógł osiągać większą masę w znacznie krótszym (o 40 %) czasie niż ryby nietransgeniczne. Całkowita ilość paszy potrzebna do wytworzenia tej samej masy ryby została zmniejszona o 25 %. Transgeniczne łososie wykazywały większą zdolność do zaspokajania potrzeb energetycznych z niebiałkowych składników paszy, co umożliwiało skierowanie części aminokwasów z diety do biosyntezy białek, zamiast ich katabolizowania na potrzeby energetyczne. Obecność białka stanowi największy i zarazem najdroższy składnik paszy łososia, a także jest głównym źródłem zanieczyszczeń azotowych w hodowli tych ryb. Uzyskane wyniki mogą oznaczać bardzo korzystne zmiany metabolizmu energetycznego, które mogłyby doprowadzić do bardziej oszczędnej i ekologicznie zrównoważonej hodowli łososia atlantyckiego, zwłaszcza gdy są one prowadzone w zamkniętych systemach lądowych.
Wstępne wyniki wskazują na zróżnicowaną ekspresję kluczowych genów dla TG – triacylogliceroli (EO-1α) łososia atlantyckiego regulujących względne poziomy, przy których aminokwasy, kwasy tłuszczowe i glukoza wchodzą w mitochondrialny cykl TCA (cykl kwasów trikarboksylowych, inaczej cykl Krebsa) w celu wytworzenia energii.
Dokumentem opisującym procedurę dopuszczenia na rynek zmodyfikowanego łososia jest NADA 141-454 (ang. New Animal Drug Application), który składa się m.in. z definicji produktu, molekularnej charakterystyki konstruktu, charakterystyki molekularnej linii zwierząt zmodyfikowanych genetycznie, charakterystyki fenotypowej zwierzęcia zmodyfikowanego genetycznie, genetycznej i genotypowej stabilności, bezpieczeństwa żywności i pasz oraz bezpieczeństwa środowiskowego.
Ocena bezpieczeństwa produktów pochodzących z łososia AquAdvantage
W ramach przeglądu wniosku NADA 141-454 odbyło się otwarte spotkanie publiczne, na którym przedstawiono dokumenty środowiskowe. Na ich podstawie FDA uznała łososia AquAdvantage, firmy AquaBounty, za fenotypowo identycznego z łososiem atlantyckim scharakteryzowanym przez FDA w „Referencyjnej encyklopedii ryb”. Stwierdzono ponadto, że profil odżywczy obu łososi jest porównywalny. W ramach oceny bezpieczeństwa FDA przebadała trzy grupy ryb: niemodyfikowane hodowlane łososie atlantyckie z farmy producenta oraz z innego komercyjnego gospodarstwa, a także łososie AquAdvantage. Nie stwierdzono biologicznie istotnych różnic pod względem składu ogólnego (w tym białka ogółem i tłuszczu ogółem) i szczegółowego (np. specyficznych aminokwasów, witamin, kwasów tłuszczowych, proporcji kwasów tłuszczowych, w tym kwasów tłuszczowych n-3 i n-6). W badaniu porównano zawartość najważniejszych hormonów (w tym hormonu wzrostu – 10,40 ng/g, estradiolu, testosteronu, 11-ketotestosteronu, T3, T4) i nie stwierdzono biologicznych różnic. Istotne różnice wykazano w zakresie zawartości insulinopodobnego czynnika wzrostu 1 (IGF 1) – 10,26 ng/g wobec 7,34 ng/g w grupie kontrolnej. Wykazano, że różni się on od ludzkiego czynnika, a jego wiązanie przez receptory jest 2- ÷ 3-krotnie mniej efektywne. Z kolei Benessia i Barbiero twierdzą, że są to dane bardzo przybliżone. Nie podano warunków, w jakich przeprowadzono badanie, a powinowactwo receptor/hormon u tak różnych gatunków nie jest zbadane. Ponadto w przypadku zaburzenia ekspresji hormonu wzrostu badanie możliwych konsekwencji zdrowotnych powinno uwzględniać bezpośrednie i pośrednie skutki dla całościowego metabolizmu komórek.
Wątpliwości dotyczące łososia AquAdvantage, w tym ocena bezpieczeństwa czyoszacowanie ryzyka zdrowotnego, zostały opisane przez wielu autorów, m.in. przez: Benessię i Barbiera, van Eenennaama i Olina, van Eenennaama i Muira, Noaha . Z kolei Yang i wsp. przedstawili oszacowanie ryzyka zdrowotnego w przypadku mięsa i mleka pochodzących z transgenicznych zwierząt.
W celu uniemożliwienia łososiom AquAdvantage ucieczki do środowiska naturalnego muszą być spełnione rygorystyczne warunki, tzn. łososie nie mogą być hodowane w zagrodach oceanicznych, lecz w zamkniętych, śródlądowych zbiornikach. Jeden z nich mieści się w Kanadzie, gdzie znajduje się stado hodowlane, a drugi w Panamie, gdzie z ikry pochodzącej z Kanady ryby są hodowane do czasu osiągnięcia odpowiednich wymiarów spełniających wymagania rynku. Oba obiekty zostały wyposażone w wiele barier fizycznych w celu zapobieżenia wydostaniu się ikry lub ryb na zewnątrz zbiorników. Ponadto barierą biologiczną jest bezpłodność samic łososia uzyskana za pomocą potrojenia kompletu chromosomów (triptoidalność).
Według Devlina i wsp., gdy transgeniczne łososie Oncorhynchus kisutch są hodowane w tym samym zbiorniku co ich nietransgeniczne odpowiedniki, a dostępnego pożywienia jest pod dostatkiem, ryby rozwijają się bez zakłóceń. W warunkach ograniczonych zasobów pożywienia łososie transgeniczne zachowują się agresywnie – dominują nad łososiami nietransgenicznymi i uniemożliwiają ich wzrost. Żywiąc się mniejszymi osobnikami nietransgenicznymi, prowadzą w ten sposób obie populacje do wyginięcia. W tych samych warunkach niedoboru żywności nietransgeniczne łososie hodowlane przetrwałyby bez uszczerbku.
Matematycznej analizy ryzyka wystąpienia szkód ze zwierzęcia GM podjął się Muir. W przypadku organizmów zmodyfikowanych genetycznie ryzyko jest wynikiem prawdopodobieństwa (P) narażenia związanego z tym, czy transgen może się rozprzestrzenić (P narażenia) oraz szkody, jeśli transgen się rozprzestrzeni (P szkody/ narażenia). Prawdopodobieństwo (P) ekspozycji składa się z co najmniej dwóch czynników. Pierwszym z nich jest prawdopodobieństwo, że osobnik wydostanie się poza zbiornik, rozproszy się i stanie się dziki (P ucieczki). Drugim czynnikiem jest zdolność samego transgenu do rozprzestrzeniania się w dzikiej populacji, gdy został już wprowadzony do organizmu zbiegłego zwierzęcia (P rozprzestrzenienia się transgenu/ ucieczki). Tak więc ogólne równanie do oceny ryzyka wystąpienia szkód ze zwierzęcia GM ma postać: ryzyko = P (szkody/narażenia) × P (ucieczki) × P (rozprzestrzenienie się transgenu/ucieczki).
W związku z dążeniami producentów do poszerzania źródeł żywności o zwierzęta transgeniczne Organizacja Narodów Zjednoczonych do Spraw Wyżywienia i Rolnictwa (FAO) wyraża swoje obawy odnośnie do zdrowia ludzi, bioróżnorodności, dobrostanu zwierząt oraz komunikacji. Są to najważniejsze obszary ryzyka, które należy określić przed wykorzystywaniem zwierząt transgenicznych. Ponadto ryzyko związane ze stosowaniem GMO musi być analizowane i oceniane w sposób bardziej realistyczny i niezawodny niż do tej pory. Istnieje także pilna potrzeba zrównoważonych i dokładnych informacji na temat GMO, które powinny być rozpowszechniane wśród decydentów, hodowców akwakultury i ogółu społeczeństwa. W sprawie wykorzystywania GMO konieczne są regulacje prawne wynikające z rzetelnych i obiektywnych kryteriów.
Stanowisko wobec łososia AquAdvantage zajął także Kongres USA. Delegacja Członków Kongresu z Alaski wyraziła dezaprobatę wobec zatwierdzenia przez FDA wniosku firmy AquaBounty. Członkowie Kongresu aktywnie wspierają konieczność etykietowania łososia GM, aby zapewnić, że konsumenci są świadomi tożsamości produktu. W 2015 roku Kongres Stanów Zjednoczonych przedstawił dwa projekty ustaw: „To amend the Federal Food, Drug, and Cosmetic Act to require labeling of geneticallyengineered fish” (H.R. 393) i “Genetically Engineered Salmon Risk Reduction Act”, w których wymaga się etykietowania łososia GM. Ponadto w kolejnych dwóch projektach ustaw: „Genetically Engineered Food Right-to-Know Act” (H.R. 913) i “Genetically Engineered Food Right-to-Know Act” sformułowano wymagania odnoszące się do etykietowania genetycznie zmodyfikowanych produktów spożywczych, w tym z łososia GM.
Znakowanie produktów spożywczych GM
Żywność pochodząca z roślin i ze zwierząt zmodyfikowanych genetycznie musi spełniać te same wymagania, w tym wymagania bezpieczeństwa i oznakowania, jak w przypadku innych produktów spożywczych. FDA może wymagać dodatkowego etykietowania żywności pochodzącej ze źródeł zmodyfikowanych genetycznie tylko wtedy, gdy nastąpiła znacząca różnica (np. w profilu odżywczym lub we właściwościach funkcjonalnych) pomiędzy produktem zmodyfikowanym i odpowiednikiem niezmodyfikowanym. W przypadku łososia AquAdvantage nie wykazano takich różnic.
FDA przyznaje, że niektórzy konsumenci chcą wiedzieć, czy kupowany przez nich łosoś atlantycki jest produktem inżynierii genetycznej. W związku z tym przedstawiono projekt poradnika z przykładami dobrowolnych oświadczeń, które producenci żywności mogą umieszczać na etykietach produktów spożywczych lub składników żywności pochodzących z łososia AquAdvantage: “Genetycznie zmodyfikowany” lub “Ten pasztet został wykonany z łososia atlantyckiego wyprodukowanego przy użyciu nowoczesnej biotechnologii.” Na etykiecie można również umieścić oświadczenie: “Ten łosoś atlantycki został genetycznie zmodyfikowany w ten sposób, że może osiągnąć masę rynkową szybciej niż jego niezmodyfikowany odpowiednik”.
Postawy konsumentów wobec żywności zmodyfikowanej genetycznie
W Polsce akceptacja społeczna produktów pochodzenia transgenicznego jest dość niska. Jedną z przyczyn tego zjawiska jest brak rzeczowej informacji o korzyściach wynikających ze stosowania osiągnięć biotechnologii. Niewystarczająca jest również popularyzacja wiedzy o ewentualnych zagrożeniach związanych z użyciem organizmów zmodyfikowanych genetycznie oraz o środkach bezpieczeństwa, jakie są podejmowane przy wprowadzaniu do obrotu produktów GM.
Na podstawie danych literaturowych w badanej populacji respondentów można wyróżnić trzy główne grupy w zakresie postaw wobec żywności zmodyfikowanej genetycznie: 1 – przeciwnicy żywności zmodyfikowanej lub pesymiści, 2 – tolerujący ryzyko lub poszukujący informacji, 3 – zwolennicy żywności zmodyfikowanej lub optymiści. Można stwierdzić, że w Stanach Zjednoczonych i niektórych krajach europejskich, m.in. w Hiszpanii, Portugalii i we Włoszech społeczeństwa są zasadniczo bardziej tolerancyjne w stosunku do żywności zmodyfikowanej genetycznie i uważają, że korzyści związane z tą żywnością przewyższają potencjalnie ryzyko zdrowotne. W większości krajów europejskich, a zwłaszcza we Francji, w krajach skandynawskich, w Wielkiej Brytanii i w Niemczech konsumenci uważają, że korzyści związane z genetycznie zmodyfikowaną żywnością są niewystarczające, aby zniwelować potencjalne zagrożenie zdrowotne.
Zdrowie i dobrostan transgenicznych zwierząt gospodarskich
Ocena bezpieczeństwa genetycznie zmodyfikowanych roślin przeprowadzana jest zgodnie z międzynarodowo zsynchronizowaną metodyką, podstawą której jest porównanie produktów GM z konwencjonalnymi, wyznaczające kolejne etapy oceny. Oczekuje się, że w niedalekiej przyszłości na różnych rynkach, początkowo nieeuropejskich, pojawią się również genetycznie modyfikowane zwierzęta stąd podjęto już międzynarodowe wysiłki zmierzające do ujednolicenia metodyki oceny bezpieczeństwa takich produktów, które zaowocowały już wydaniem stosownych rekomendacji w Codex Alimentarius. W ocenę modyfikacji genetycznych zaangażowano się w ramach projektu PEGASUS, finansowanego przez Unię Europejską. W ramach projektu zostanie rozpatrzone postrzeganie zwierząt genetycznie zmodyfikowanych, korzyści i zagrożenia związane z ich wykorzystaniem oraz perspektywy rozwoju z punktu widzenia nauk socjologicznych i przyrodniczych.
W literaturze przedmiotu brak jest wyczerpujących danych na temat skutków transgenezy i technologii wykorzystywanych w procesie tworzenia transgenicznych zwierząt gospodarskich (np. wpływ transferu jądra komórki somatycznej na dobrostan zwierząt). Obecny stan wiedzy na temat zagrożeń dotyczących dobrostanu zwierząt transgenicznych wynika z niejednoznacznych doświadczeń lub prowadzonych na małą skalę Systematyczne badania nad dobrostanem zwierząt gospodarskich poddanych transgenezie mogą przyczynić się zarówno do poprawy bezpieczeństwa samych metod, jak również selekcji i rozmnażania zwierząt zdrowych, a tym samym umożliwić postęp technologiczny.
Rozwój inżynierii genetycznej pozwolił na wyhodowanie zwierząt genetycznie zmodyfikowanych, wykorzystywanych głównie w medycynie jako modele w badaniu chorób człowieka. Postęp transgenezy zwierząt gospodarskich jest wolniejszy, a zdecydowana większość prac jest dopiero na etapie badań. Jednym z głównych celów genetycznej modyfikacji zwierząt, ważnych gospodarczo, jest poprawa właściwości fizykochemicznych mleka (w tym udział poszczególnych frakcji kazeiny). Udoskonalono również skład wieprzowiny poprzez zwiększenie ogólnej masy mięśniowej świń, zmieniono także skład tłuszczu mięśniowego w kierunku zmniejszenia spożycia tłuszczów nasyconych, a zwiększenia spożycia tłuszczów nienasyconych. Przykładem zmodyfikowanego produktu jest transgeniczny łosoś AquAdvantage. Konieczny jest rozwój odpowiednich narzędzi do oceny ryzyka i prowadzenie dalszych, pogłębionych badań dotyczących wpływu na zdrowie oraz oddziaływania na środowisko i oceny skutków społecznych. Akceptacja społeczna żywności wytworzonej na bazie produktów transgenicznych jest dość mała. Konieczne jest prowadzenie debat publicznych przy wykorzystaniu do tego celu środków masowegoprzekazu i upowszechnianie wiedzy o organizmach genetycznie zmodyfikowanych.
Żrodło: Anioł A., Bujak H., Dalbiak A., Giźiński M., Głowacka B., Linkiewicz A., Oleszczuk S., Rybak J., Sawicka-Sienkiewicz E., Sowa S., Twardowski T., Zimny J., Zimny T., Narklewicz-Jodko J., Połanecki P., Wiąckowski S., Żarski T.: Organizmy genetycznie zmodyfikowane. Materiały szkoleniowe. Projekt realizowany dla Ministerstwa Środowiska i Centrum Informacji o Środowisku. Polskie Zrzeszenie Inżynierów i Techników Sanitarnych, Oddział Wielkopolski, Poznań 2007, ss. 35-89.Beardmore J.A., Porter J.S.: Genetically modified organisms and aquaculture. FAO Fisheries CircularNo 989. Rome 2003, pp. 1-40.Benessia A., Barbiero G.: The impact of genetically modified salmon: From risk assessment to quality evaluation. Visions for Sustainability, 2015, 3, 35-61.Bodnar A.: Risk assessment and mitigation of AquAdvantage salmon. Infor. Syst. Biotechnol., 2010,Spec. Issue, 1-7.Bolstad E.: Activists fight FDA approval of AquaBounty’s genetically engineered salmon. [on line]. McClatchy Newspapers. Dostęp w Internecie [05.03.2013]: http://www.mcclatchydc.com/news/nation-world/national/article24745840.html Brophy B., Smolenski G., Wheeler T., Wells D., L’Huillier P., Laible G.: Cloned transgenic cattle produce milk with higher levels of β-casein and κ-casein. Nat. Biotechnol., 2003, 21 (2), 157-162.Costa-Font M., Gil J.M., Traill W.B.: Consumer acceptance, valuation of and attitudes towards genetically modified food: Review and implications for food policy. Food Policy, 2008, 33, 99-111.Denning C., Burl S., Ainslie A., Bracken J., Dinnyes A., Fletcher J., King T., Ritchie M., Ritchie W.A., Rollo M., De Sousa P., Travers A., Wilmut I., Clark A.J.: Deletion of the α(1,3)galactosyl transferase (GGTA1) gene and the prion protein (PrP) gene in sheep. Nat. Biotechnol., 2001, 19, 559-562.Devlin R.H., Biagi C.A., Yesaki T.Y.: Growth, viability and genetic characteristics of GH transgenic coho salmon strains. Aquaculture, 2004, 236, 607-632.Duan B., Cheng L., Gao Y., Yin F.X., Su G.H., Shen Q.Y., Liu K., Hu X., Liu X., Li G.P.: Silencing of fat-1 transgene expression in sheep may result from hypermethylation of its driven cytomegalovirus (CMV) promoter. Theriogenology, 2012, 78 (4), 793-802.FDA: AquAdvantage salmon fact sheet. [on line]. Dostęp w Internecie [01.04.2016]:FDA: Briefing packet: AquAdvantage Salmon. [on line]. Veterinary Medicine Advisory Committee. Dostęp w Internecie [01.04.2016]:FDA: Freedom of information summary. Original new animal drug application. NADA 141-454. [on line]. Dostęp w Internecie [01.04.2016]: www.fda.gov/downloads/AnimalVeterinary/DevelopmentApprovalProcess/GeneticEngineering/GeneticallyEngineeredAnimals/UCM466215.pdf ,FDA: Draft guidance for industry: Voluntary labeling indicating whether food has or has not been derived from genetically engineered Atlantic salmon. [on line]. Dostęp w Internecie [01.04.2016]:www.fda.gov/Food/GuidanceRegulation/GuidanceDocumentsRegulatoryInformation/ucm469802.htm, FDA: Finding of no significant: AquAdvantage Salmon. [on line]. Dostęp w internecie[01.04.2016]:www.fda.gov/downloads/AnimalVeterinary/DevelopmentApprovalPr cess/GeneticEngineering/GeneticallyEngineeredAnimals/UCM466219.pdf FDA: Questions and answers on FDA’s approval of AquAdvantage salmon. [on line]. Dostęp w Internecie [01.04.2016]: http://www.fda.gov/AnimalVeterinary/DevelopmentApprovalProcess/GeneticEngineering/GeneticallyEngineeredAnimals/ucm473237.htm Forabosco F., Löhmus M., Rydhmer L., Sundström L.F.: Genetically modified farm animals and fishin agriculture: A review. Livestock Sci., 2013, 153 (1-3), 1-9.Ganga R., Tibbetts S.M., Wall C.L., Plouffe D.A., Bryenton M.D., Peters A.R., Runighan C.D., Buchanan J.T., Lall S.P.: Influence of feeding a high plant protein diet on growth and nutrient utilization to combined ‘all-fish’ growth-hormone transgenic diploid and triploid Atlantic salmon (Salmo salar L.). Aquaculture, 2015, 446, 272-282. Gordon J.W., Scangos G.A., Plotkin D.J., Barbosa J.A., Ruddle F.H.: Genetic transformation of mouse embryos by microinjection of purified DNA. PNAS, 1980, 77, 7380-7384. H.R.393. To amend the federal food, drug, and cosmetic act to require labeling of genetically engineered fish. [on line]. Dostęp w Internecie [01.04.2016]: https://www.congress.gov/bill/114thcongress/house-bill/393 H.R.913. Genetically engineered food right-to-know act. [on line]. Dostęp w Internecie [01.04.2016]: https://www.congress.gov/bill/114th-congress/house-bill/913 Hammer R.E., Pursel V.G., Rexroad Jr C.E., Wall R.J., Bolt D.J., Ebert K.M., Palmiter R.D., Brinster R.L.: Production of transgenic rabbits, sheep and pigs by microinjection. Nature, 1985, 315(6021), 680-683. Houdebine L.M.: Production of pharmaceutical proteins by transgenic animals. Compar. Immunol.,Microbiol. Infect. Diseases, 2009, 32 (2), 107-121.Huang J., Xiong Y., Li T., Zhang L., Zhang Z., Zuo B., Xu D., Ren Z.: Ectopic overexpression of swine PPARγ2 upregulated adipocyte genes expression and triacylglycerol in skeletal muscle of mice. Transgenic Res., 2012, 21 (6), 1311-1318. Jost B., Vilotte J.L., Duluc I., Rodeau J.L., Freund J.N.: Production of low-lactose milk by ectopic expression of intestinal lactase in the mouse mammary gland. Nat. Biotechnol., 1999, 17 (2), 160-164. Kang J.X., Wang J., Wu L., Kang Z.B.: Transgenic mice: Fat-1 mice convert n-6 to n-3 fatty acids. Nature, 2004, 427 (6974), 504. Kleter G.A., Kok E.J.: Safety assessment of biotechnology used in animal production, includinggenetically modified (GM) feed and GM animals – A review. Animal Sci. Pap. Rep., 2010, 28(2),105-114. Kosicka-Gębska M., Gębski J.: Oczekiwania i obawy związane z wprowadzeniem do obrotu produktów i żywności pochodzących z modyfikacji genetycznych. Zesz. Nauk. SGGW w Warszawie –Probl. Roln. Świat., 2009, 9 (24), 65-76. Kues W.A., Niemann H.: The contribution of farm animals to human health. Trends Biotechnol., 2004, 22 (6), 286-294.Lai L., Kang J.X., Li R., Wang J., Witt W.T., Yong H.Y., Hao Y., Wax D.M., Murphy C.N., Rieke A., Samuel M., Linville M.L., Korte S.W., Evans R.W., Starzl T.E., Prather R.S., Dai Y.: Generationof cloned transgenic pigs rich in omega-3 fatty acids. Nat. Biotechnol., 2006, 24 (4), 435-436. Mozdziak P.E., Petitte J.N.: Transgenic animal technology and meat quality. In.: Meat Quality: Genetic and Environmental Factors. Eds. W. Przybylski, D. Hopkins. CRC Press, Boca Raton 2015, pp. 415-427. Muir W.M.: The threats and benefits of GM fish. EMBO reports, 2004, 5 (7), 654-659. Niemann H., Kues W., Carnwath J.W.: Transgenic farm animals: Present and future. Rev. Sci. Technol., 2005, 24 (1), 285-298. Noah L.: Whatever happened to the 'frankenfish'?: The FDA's foot-dragging on transgenic salmon. Maine Law Rev., 2013, 65, 232-251.Oakes J.D., Higgs D.A., Eales J.G., Devlin R.H.: Influence of ration level on the growth performance and body composition of non-transgenic and growth-hormone-transgenic coho salmon (Oncorhynchus kisutch). Aquaculture, 2007, 265, 309-324. Ormandy E.H., Dale J., Griffin G.: Genetic engineering of animals: Ethical issues, including welfare concerns. Can. Vet. J., 2011, 52 (5), 544-550. Pan D., Zhang L., Zhou Y., Feng Ch., Long Ch., Liu X., Wan R., Zhang J., Lin A., Dong E., Wang S., Xu H., Chen H.: Efficient production of omega-3 fatty acid desaturase (sFat-1)-transgenic pigs by somatic cell nuclear transfer, 2010, Sci. China Life Sci., 53 (4), 517-523.Petitte J.N., Mozdziak P.E.: Production of transgenic poultry. In: Transgenic Animal Technology: A Laboratory Handbook. 2nd ed. Ed. C.A. Pinkert. Academic Press, Rochester, New York, USA, 2002, pp. 279-306.Pfeifer A.: Lentiviral transgenesis – A versatile tool for basic research and gene therapy. Curr. Gene Ther., 2006, 6 (4), 535-542. Pinkert C.A.: Transgenic Animal Technology: A Laboratory Handbook. 2nd ed. Academic Press, Rochester, New York, USA, 2002.Pursel V.G., Wall R.J., Mitchell A.D., Elsasser T.H., Solomon M.B., Coleman M.E., Mayo F., Schwartz R.J.: Expression of insulin-like growth factor-I in skeletal muscle of transgenic pigs. In: Transgenic Animals in Agriculture. Eds. J.D. Murray, G.B. Anderson, A.M. Oberbauer, M.M. McGloughlin. CABI Publishing, New York 1999, pp. 131-144.Pursel V.G., Mitchell A.D., Bee G., Elsasser T.H., McMurtry J.P., Wall R.J., Coleman M.E., Schwartz R.J.: Growth and tissue accretion rates of swine expressing an insulin-like growth factor I transgene. Anim. Biotechnol., 2004, 15 (1), 33-45.Qin Y., Chen H., Zhang Y., Zhu C., Gao B., Yin Y., Li W., Shi Q., Zheng M., Xu Q., Song J., Li B.: Cloning of the Xuhuai goat PPARγ gene and the preparation of transgenic sheep. Biochem. Genet., 2013, 51 (7), 543-553.Quinn L.S., Anderson B.G., Strait-Bodey L., Stroud A.M., Argiles J.M.: Oversecretion of interleukin- 15 from skeletal muscle reduces adiposity. Am. J. Physiol. Endocrinol. Metab., 2009, 296, 191-202.Roorda B.D., Hesselink M.K., Schaart G., Moonen-Kornips E., Martínez-Martínez P., Losen M., DeBaets M.H., Mensink R.P., Schrauwen P.: DGAT1 overexpression in muscle by in vivo DNA electroporation increases intramyocellular lipid content. J. Lipid Res., 2005. 46, 230-236.S.511. Genetically engineered food right-to-know act. [on line]. Dostęp w Internecie [01.04.2016]: https://www.congress.gov/bill/114th-congress/senate-bill/511 S.738. Genetically engineered salmon risk reduction act. [on line]. Dostęp w Internecie [01.04.2016]: https://www.congress.gov/bill/114th-congress/senate-bill/738 Saeki K., Matsumoto K., Kinoshita M., Suzuki I., Tasaka Y., Kano K., Taguchi Y., Mikami K., Hirabayashi M., Kashiwazaki N., Hosoi Y., Murata N., Iritani A.: Functional expression of a Delta12 fatty acid desaturase gene from spinach in transgenic pigs. Proc. Natl. Acad. Sci. USA, 2004, 101 (17), 6361-6366. Solomon M.B., Pursel V.G., Paroczay E.W., Bolt D.J.: Lipid composition of carcass tissue from transgenic pigs expressing a bovine growth hormone gene. J. Anim. Sci., 1994, 72 (5), 1242-1246. Stinnakre M.G., Vilotte J.L., Soulier S., Mercier J.C.: Creation and phenotypic analysis of α- lactalbumindeficient mice. Proc. Natl. Acad. Sci. USA, 1994, 91 (14), 6544-6548. Tibbetts S.M., Wall C.L., Barbosa-Solomieu V., Bryenton M.D., Plouffe D.A., Buchanan J.T., Lall S.P.: Effects of combined ‘all-fish’ growth hormone transgenics and triploidy on growth and nutrient utilization of Atlantic salmon (Salmo salar L.) fed a practical grower diet of known composition. Aquaculture, 2013, 406/407, 141-152. Upton H.F., Cowan T.: Genetically Engineered Salmon. Congressional Research Service, 2015. Van Eenennaam A., Olin.G.: Careful risk assessment needed to evaluate transgenic fish. Cal. Agric., 2006, 3 (60), 126-131.Van Eenennaam A.L., Muir W.M.: Transgenic salmon: A final leap to the grocery shelf? Nat. Biotechnol.,2011, 29 (8), 706-710. Van Reenen C.G., Meuwissen T.H., Hopster H., Oldenbroek K., Kruip T.H, Blokhuis H.J.: Transgenesis may affect farm animal welfare: A case for systematic risk assessment. J. Anim. Sci.,2001, 79 (7), 1763-1779. Van Reenen C.G.: Assessing the welfare of transgenic farm animals. In.: Genetic Engineering in Livestock. New Applications and Interdisciplinary Perspectives. Eds. M. Engelhard, K. Hagen, M. Boysen. Springer-Verlag, Berlin 2009, pp. 119-143.Wang W., Guo X.M., Wang J., Lai S.J.: Product fat-1 transgenic simmental cattle endogenously synthesizing omega-3 polyunsaturated fatty acid using OSM. J. Anim. Vet. Adv., 2012, 11, 1041- 1045.Wheeler M.B., Bleck G.T., Donovan S.M.: Transgenic alteration of sow milk to improve piglet growth and health. Reproduction, 2001, 58, 313-324.Xu Q., Feng C.Y., Hori T.S., Plouffe D.A., Buchanan J.T., Rise M.L.: Family-specific differences ingrowth rate and hepatic gene expression in triploid growth hormone (GH) transgenic Atlantic salmon (Salmo salar). Comp. Biochem. Physiol. Part D 8 Genomics Proteomics, 2013, 8 (4), 317-333.Yang X., Tian X.C., Kubota C., Page R., Xu J., Cibelli J., Seidel G Jr.: Risk assessment of meat and milk from cloned animals. Nat. Biotechnol., 2007, 25, 77-82.Yong H.Y., Hao Y., Lai L., Li R., Murphy C.N., Rieke A., Wax D., Samuel M., Prather R.S.: Production of a transgenic piglet by a sperm injection technique in which no chemical or physical treatments were used for oocytes or sperm. Mol. Reprod. Dev., 2006, 73 (5), 595-599.Zhou Y., Lin Y., Wu X., Feng C., Long C., Xiong F., Wang N., Pan D., Chen H.: The high-level accumulation of n-3 polyunsaturated fatty acids in transgenic pigs harboring the n-3 fatty acid desaturase gene from Caenorhabditis briggsae. Transgenic Res., 2014, 23 (1), 89-97.Zwierzchowski L.: Nowe właściwości zwierząt modyfikowanych genetycznie. W: GMO w świetle najnowszych badań. Red. K. Niemirowicz-Szczytt. Wyd. SGGW, Warszawa 2012, s. 87-122.,Katarzyna Kajak-Siemiaszko, Kinga Boruszewska,Wiesław Przybylski
____________________________________________________
Ciekawostka
przyp. Wyspa doktora Moreau (ang. The Island of Doctor Moreau) – powieść science fiction, napisana w 1896 roku przez H.G. Wellsa, poruszająca kwestie społeczeństwa, natury ludzkiej, religii, darwinizmu i eugeniki, a także niebezpieczeństwa wynikającego z niekontrolowanych i nieodpowiedzialnie prowadzonych badań naukowych. W czasie gdy była pisana w Wielkiej Brytanii toczyła się debata na temat wiwisekcji, zabiegu operacyjnego wykonywanego na żywym zwierzęciu w celach badawczych.
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny










Więcej
Czy ludzie agresywni powinni być izolowani i co się dzieje z ich mózgiem?
Czy Polsce grozi epidemia Ćpunów?
Ci ludzie są tak głupi a może tak mądrzy albo chorzy?