Ostatnia aktualizacja 28 lipca 2022
Streszczenie
Insulinomy to najczęściej występujące guzy neuroendokrynne trzustki. W ciągu roku występują u 1 – 4 osób na 1 mln. W przeciwieństwie do innych guzów neuroendokrynnych trzustki, mają charakter łagodny i pojedynczy w momencie diagnozy. Ze względu na łagodny charakter stosuje się leczenie chirurgiczne, przynoszące znakomite długoterminowe rezultaty. Wprowadzenie minimalnie inwazyjnych technik w leczeniu chirurgicznym zyskuje na coraz większej popularności. Ze względów kosmetycznych, mniejsze blizny po operacji i krótszy termin popytu pacjenta w szpitalu po operacji. Występujące powikłania są porównywalne do tych z chirurgi otwartej. Przedoperacyjna lokalizacja guza ma ogromne znaczenie dla właściwego wyboru metody chirurgicznej. Istnieje wiele inwazyjnych i nieinwazyjnych metod lokalizacji insulinomy. Połączenie tych dwóch zazwyczaj jest wystarczające by przed operacją zlokalizować nowotwór. Laparoskopowe USG jest obowiązkowe, by zlokalizować guzy śródoperacyjnie. Pomimo bogatego doświadczenia w powstawaniu wysoko wykwalifikowanych centrów i obiecujących rezultatów, brak randomizowanych badań. Których zrealizowanie byłoby konieczne dla potwierdzenia rzadkości występowania insulinomy wśród populacji. W tym artykule przedstawiono stan obecny jeśli chodzi o laparoskopowe leczenie insulinomy. Niektóre nie rozwiązane problemy i trochę szczegółów technicznych najczęściej stosowanych w zabiegach laparoskopowych.
Wprowadzenie
Guzy neuroendokrynne trzustki (PanNETs), są rzadką grupą nowotworów hormonalnie czynnych trzustki. Guzy te dalej klasyfikowane są w zależności od tego czy są hormonalnie czynne lub bierne, złośliwe lub łagodne, pojedyncze lub mnogie.1 Pierwszy guz (PanNET) zidentyfikowano prawie 90 lat temu. Jego nazwa oznacza zachowanie biologiczne guza i skłonności do wydzielania znacznych ilości insuliny, co prowadzi do objawów klinicznych hipoglikemii.
PanNETs w całości stanowią tylko koło 1-2% nowotworów trzustki.2 Biorąc to pod uwagę nie można być zdziwionym, że trudne jest oszacowanie ilości ich występowania wśród populacji. Badania oparte na sprawozdaniach z sekcji zwłok wykazały, że insulinomy są wyjątkowo rzadkie.3 Większość informacji epidemiologicznych dotyczących występowania tych guzów pochodzi z Olmsted County w Minnesocie (USA). Badanie retrospektywne obejmujące 6 dekad, oszacowało częstość występowania insulinom na 4 przypadki/1 mln rocznie.4 Warto zwrócić uwagę na to, że zaobserwowano tendencję wzrostu zachorowań w ostatnich dwóch dekadach badań. Taki trend wzrostowy zaobserwowano w odniesieniu do kilku odmian nowotworów neuroendokrynnych układu pokarmowego. Najczęściej wykazywano, że jest to spowodowane udoskonaleniem technik diagnostycznych.
W oparciu o dostępne informacje dotyczące chorych, nie stwierdzono by płeć miała wpływ na zachorowanie. Występuje raczej u obu płci w równym stopniu. Gdy występują sporadyczne (ok. 90%) i są pojedyncze mogą być skutecznie leczone przez ograniczoną resekcję.4
Natomiast w przypadku gdy insulinoma należy do mnogich zespołów nowotworów wewnątrzwydzielniczych (MEN) typu 1, ma tendencję do mnogości (4-10%) oraz złośliwości (do 25%). Zwykle wymagają bardziej skomplikowanej operacji i szerokiego wycięcia tkanki łącznej trzustki.4-6 Zauważa się także odwrotność, u ok. 10% pacjentów z zespołem MEN1 wykształcają się wyspiaki (insulinomy). Chociaż insulinoma może wystąpić w ciągu całego życia, to średni wiek w chwili rozpoznania szacuje się na 47 lat (zakres od 8 do 82 lat).7 W przypadku rozpoznania MEN1 średni wiek w chwili rozpoznania jest niższy, wynosi 25 lat lub mniej. Anatomiczny rozkład może być różny i występować w głowie, trzonie lub ogonie trzustki. Jednak przeważnie usytuowany jest w trzonie lub ogonie.4,6,8 Większość ma średnicę mniejszą niż 2 cm, podczas gdy nowotwory złośliwe mierzą zwykle powyżej 3 cm.9 Rozpoznanie opiera się na stwierdzeniu objawów klinicznych hipoglikemii, we wczesnym okresie choroby, guzy w większości są małe w momencie rozpoznania i nadające się do wycięcia chirurgicznego.
Kliniczne podejrzenie insulinomy jest uzasadnione przy występowaniu objawów hipoglikemii, u ok. 75% pacjentów badanych próbą głodową, zauważono takie objawy.10 U niektórych pacjentów hipoglikemia może występować zarówno po posiłkach jak i na czczo i być jedynym objawem.11 Objawy są podzielone na neuroglikopeniczne, które są wynikiem dysfunkcji ośrodkowego układu nerwowego w wyniku braku glukozy, jego podstawowego podłoża energii oraz takie, które występują w ramach reakcji na stres i w konsekwencji uwalnianie katecholamin. Podczas napadu hipoglikemii u pacjenta, może zdarzyć się zaburzenie ostrości widzenia i zmiany w zachowaniu. Ze względu na pobudzenie autonomicznego układu nerwowego może wystąpić obfite pocenie, kołatanie serca oraz drżenie mięśni.11 W ciężkich przypadkach występuje senność, śpiączka, zaburzenia oddychania i krążenia mogące doprowadzić do śmierci.
Dawniej, triada Whipple’a ( hipoglikemia występuje w trakcie głodzenia; spadek poziomu glukozy < 50mg/dl; objawy ustępują po podaniu węglowodanów) podsumowywała kliniczny obraz i rozpoznanie insulinomy. Obecnie nadal jest wykorzystywana do diagnozy hipoglikemii u pacjentów bez cukrzycy. 12 Rozpoznanie insulinomy zależy od udokumentowania niewłaściwie podwyższonego poziomu insuliny w warunkach niskiego poziomu krążącej glukozy. Specyficzne kryteria zostały opracowane na podstawie badań krwi, w celu potwierdzenia diagnozy.13 Gdy stwierdzono stan niespójnej hiperinsulinemii, niezbędne są badania lokalizacyjne do wizualizacji guza.
Strategia terapeutyczna zarówno w przypadku łagodnych i złośliwych wyspiaków, to zazwyczaj leczenie chirurgiczne lub przezskórna ablacja zmian, a w przypadku przerzutów chemioterapia.13,14 Pierwszy zabieg leczenia insulinomy został opisany w roku 1929.12 W zależności od lokalizacji i stopnia choroby, opcje chirurgiczne obejmują wyłuszczenie i/lub wycięcie miąższu trzustki. Przed pojawieniem się mało inwazyjnych technik chirurgicznych i zaawansowanych metod obrazowania, każdy prosty zabieg wycięcia nawet w łatwo dostępnych obszarach wiązał się koniecznością ekspozycji trzustki poprzez duże nacięcie brzucha. Nierzadko, trudności i niepewność śródoperacyjnej identyfikacji zmian prowadziły do przekształcenia stosunkowo prostego zabiegu w taki o wysokim ryzyku i śmiertelności. Chirurgia laparoskopowa i przed – oraz śród – operacyjny sposób obrazowania całkowicie zmieniły sposób leczenia insulinomy. Zachowanie miąższu trzustki jest obecnie uważane za konieczne, guz jest mały, w większości pojedynczy i łagodny co daje możliwość całkowitego wyleczenia poprzez wycięcie.4 Kombinacja przedoperacyjnych badań obrazowych (inwazyjnych i nieinwazyjnych) oraz ultrasonografia śród-operacyjna sprawiają, że wycięcie laparoskopowe guza jest technicznie wykonalne i bezpieczne w ośrodkach o wysokim poziomie fachowej wiedzy. Poniżej podsumowanie i komentarz dotyczący aktualnych postępów w laparoskopowym leczeniu insulinomy.
Umiejscowienie guza
Po wykryciu nieprawidłowo wysokiego poziomu insuliny, techniki obrazowania są używane do weryfikacji i lokalizacji obecności jednego lub kilku guzów. Przedoperacyjna lokalizacja insulinom ma ogromne znaczenie w ich leczeniu. Lokalizacja, liczba i ich stosunek do ważnych struktur anatomicznych są najważniejszymi wyznacznikami dla zabiegu. Tradycyjną, standardową procedurę chirurgiczną na ślepo stosuje się, gdy guz nie może zostać śród-operacyjnie wizualizowany czy wyczuty. Jednakże zaawansowane techniki lokalizacji sprawiły, że resekcja na ślepo jest już metodą przestarzałą.15 Jak wcześniej wspomniano, insulinoma jest zwykle łagodne i większość pacjentów po wycięciu guza jest zupełnie zdrowa, nawet po dłuższym okresie obserwacji. W związku z tym obszerne resekcje trzustki nie są już zalecane, ze względu na około-operacyjne i pooperacyjne zachorowania i umieralność.
Dostępnych jest obecnie kilka inwazyjnych i nieinwazyjnych metod obrazowania, wybór zależy od lokalnych doświadczeń w danej placówce medycznej, dostępności oraz preferencji pacjenta. Badania obrazowe dostarczają ważnych informacji na temat lokalizacji guza, zakresu miejscowego naciekania i obecności zmian przerzutowych. Badania obrazowe obejmują inwazyjne i nieinwazyjne testy na przedoperacyjnej lokalizacji oraz laparoskopową ultrasonografię śród-operacyjną danej lokalizacji.
Badania nieinwazyjne obejmują tomografię komputerową (CT), rezonans magnetyczny (MRI), USG, pozytonową tomografię emisyjną (PET) z najczęściej stosowanym radiofarmaceutykiem w onkologii 18F-fluorodeoxyglukozą. W niektórych przypadkach stosuje się jako pierwsze USG, ze względu na powszechną dostępność, niski koszt badania i brak narażania pacjenta na działanie promieniowania. Główne wady tej metody to zależność od wiedzy operatora, trudności w ocenie struktur w jamie brzusznej u otyłego pacjenta i mniejsza wrażliwość na zmiany o małej średnicy (<2cm) oraz guzy zlokalizowane w ogonie trzustki.16,17 Jednak w niektórych dużych ośrodkach stwierdzono, że badanie USG z kontrastem jest metodą porównywalnie skuteczną co konwencjonalna tomografia komputerowa.18
CT jest najczęściej stosowanym nieinwazyjnym badaniem lokalizacyjnym przed operacją. Rutynowo używa się wzmocnienia kontrastowego, dobrze definiuje guzy pokazuje je jako zaokrąglone zmiany. Wcześniejsze badania prowadzone na dużą skalę, oceniające skuteczność CT w wykrywaniu insulinomy dały skromne rezultaty (ok. 70%).19 Jednak rozwój technologii CT drastycznie zmienił przydatność tej metody. Stała się opcją pierwszego wyboru w przedoperacyjnym wykrywaniu guzów. Dynamiczne CT (Dynamic CT) wyparło to konwencjonalne ze względu na zdolność lepszego wykrywania niewielkich zmian, wrażliwość większa o ponad 80%.21,22 Badania prowadzone na szeroką skalę udokumentowały znaczną poprawę czułości w nowych technikach tomograficznych.21 Zaletami CT w porównaniu z USG są, lepsza wizualizacja jamy brzusznej i możliwość wykluczenia patologii i przerzutów oraz mniej subiektywna interpretacja wyników obrazowych. Chirurdzy dobrze zorientowani jeśli chodzi o CT jamy brzusznej, mogą z łatwością dostrzec guza i tym samy lepiej zaplanować operację. Oczywiście są też minusy tego badania, może wyrządzić szkody u pacjentów wrażliwych na promieniowanie lub mogą wystąpić reakcje alergiczne na środek kontrastowy.
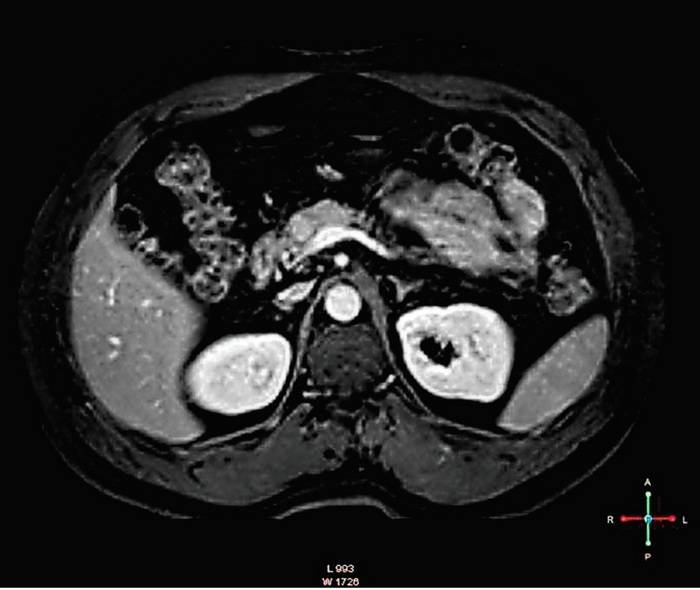
MRI (rezonans magnetyczny) jest stosowany jako badanie dodatkowe, które można stosować z powodzeniem o czym wspomniano w literaturze.22 Główną wadą tego badania jest konieczność zdyscyplinowania pacjenta, co ogranicza stosowanie tej metody jako pierwszego wyboru. Jednak opublikowane wyniki badań świadczą o tym, że MRI jest szczególnie skuteczny przy wykrywaniu insulinomy o małej średnicy. Wykrywa guzy pominięte w CT czy USG. 23,24 W obrazach T1 – zależnych insulinomy dają niskie natężenie sygnału i stosunkowo wysokie w obrazach T2 -zależnych (Ilustracja 1).25
Scyntygrafia jest wykorzystywana w sporadycznych przypadkach, ponieważ większość insulinom nie łatwo wyrazić przez dużą liczbę receptorów somatostatyny. Czułość wynosi ok. 40-50%, ale jest przydatna w dziedzicznych zespołach, takich jak MEN1, gdzie istnieje duże prawdopodobieństwo innych PanNETs.24,26
Badania inwazyjne to ultrasonografia endoskopowa (EUS), selektywna angiografia i SACS (selektywna ocena zwapnień tętnic wieńcowych). Angiografia selektywna była tradycyjnie stosowana w poprzednich dekadach jako złoty standard przedoperacyjnej lokalizacji guzów.27 Wprowadzenie technik nieinwazyjnych o podobnej lub wyższej dokładności diagnostycznej, sprawiło że ta metoda stała się nieaktualna, ze względu na swój inwazyjny charakter i ryzyko chorobotwórcze.
Badanie SACS jest unowocześnioną wersją tradycyjnego badania żył wewnątrz-wątrobowych. W czasie tej procedury, glukonian wapnia wstrzykuje się do żołądka, wątroby, śledziony i tętnicy krezkowej, po czym zbiera się próbki krwi żylnej dla sprawdzenia poziomu insuliny.28 Selektywne cewnikowanie wymienionych naczyń umożliwia niezawodną lokalizację insulinomy. Jednak zmiany anatomiczne tych naczyń, które są nierzadko spotykane mogą zaburzyć interpretację badania.29 SACS jest przydatne wtedy, gdy inne metody obrazowania nie będą skuteczne w obrazowaniu wyspiaków. Ponadto może być wykorzystana do rozróżniania wyspiaków, od innych rzadkich powodów hipoglikemii z hiperinsulinemią, jak nesidioblastoza.30,31 Ten test może odróżnić, czy wydzielanie insuliny jest zlokalizowane w konkretnym miejscu (insulinoma) czy rozłożone w całej tkance trzustki (nesidioblastoza). Odnotowano w raportach 100% czułości tej metody, dla kilku zbadanych przypadków.15,28,32 Wady tej metody to komplikacje wynikające z konieczności cewnikowania tętnic, braku jej dostępności oraz konieczność posiadania odpowiednich umiejętności technicznych.
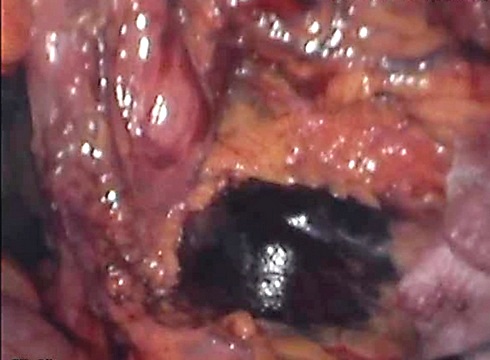
Ultrasonografia endoskopowa (EUS) wykazuje 80% czułość i stopniowo zyskuje akceptację jako ważny sposób na przedoperacyjną ocenę insulinomy. Jest uważana za metodę inwazyjną i stosowana w przypadku, gdy inne nieinwazyjne badania się nie sprawdzą. EUS umożliwia identyfikację bardzo małych zmian, nawet o średnicy 5 mm.33 Jak w przypadku gruczolaka trzustki, daje ważne informacje dotyczące, bliskości zmiany chorobowej co do większych struktur anatomicznych, jak główny przewód trzustkowy i śledziona.36 EUS opisano jako najdokładniejszą metodę lokalizacji nowotworów w głowie trzustki, najgorzej natomiast lokalizuje te umieszczone w ogonie.37,38 Zaletą EUS jest możliwość wykonania biopsji cienkoigłowej i badania cytologicznego w przypadku gdy obraz nie daje pewności i konieczne jest dokładniejsze zbadanie zmiany przed operacją (Ilustracja 2). Ponadto dla tej metody stosuje się ablację alkoholową w leczeniu insulinomy u pacjentów chirurgicznych wysokiego ryzyka.43 Wady tej techniki to konieczność odpowiedniego uspokojenia pacjenta oraz subiektywne podejście operatora.
Obecnie nie ma powszechnie przyjętych wytycznych jeśli chodzi o przedoperacyjne obrazowanie. Poprzednie raporty dotyczące nieinwazyjnych technik badań przedoperacyjnych, dotyczą stopniowo zastępowanych starszych technologii. Na przykładzie CT i MRI, wcześniejsze niezadowalające wyniki są z pewnością odzwierciedleniem tego faktu. Retrospektywne badania ujęte w testach dotyczą zarówno pojedynczych skanerów jak i multidetektorów, co prawdopodobnie wpływa na niedoszacowanie przydatności diagnostycznej CT.24 W naszym ośrodku, w przypadku sporadycznej insulinomy o charakterze łagodnym, rutynowo wykorzystuje się CT ze względu na duży potencjał w rozpoznaniu przerzutów i niską szkodliwość dla pacjentów.
Ilustracja 2: Widok inulinomy zlokalizowanej na przedniej powierzchni trzustki, podczas badania laparoskopowego. Zmiana wcześnie zaznaczona błękitem metylenowym podczas badania EUS.
Pomijamy wcześniejsze wykonywanie USG jamy brzucha, dlatego że nie jest ono tak łatwo zrozumiałe dla zespołu chirurgów jak CT. Ponadto dynamiczna tomografia komputerowa charakteryzuje się większą czułością w wykrywaniu zmian niż USG. Nie jest też ograniczona tylko do trzonu i ogona trzustki, jeśli chodzi o wykrycie zmiany. Jeśli CT nie zlokalizuje guza, lub równoległe uszkodzenia wątroby zakłócają obraz, wspomagamy się MRI. W drugim etapie używamy EUS, aby lepiej ocenić położenie guza w stosunku do odpowiednich struktur anatomicznych, takich jak przewód trzustkowy i duże naczynia krwionośne. EUS dodatkowo pozwala wykryć zmiany, które mogą nie być widoczne na CT, zwłaszcza te zlokalizowane w głowie trzustki. Przedoperacyjne oznaczenie jest zawsze stosowane, niezależnie od dostępności IOUS (ultrasonografii śród-operacyjnej), planowanej laparoskopii czy operacji otwartej. Z naszego doświadczenia wynika, że w zdecydowanej większości przypadków te metody przedoperacyjnego obrazowania są wystarczające, by określić umiejscowienie guza i zaplanować operację.
W większości przypadków kombinacja różnych inwazyjnych i nieinwazyjnych metod wystarcza, by przed operacją dokładnie ustalić położenie sporadycznie występujących insulinom. W MEN1 szczególną uwagę przywiązuje się do sprawdzenia obecności wyspiaków lub innych PanNETs w głowie trzustki, ponieważ tam najczęściej się znajdują. Pozwala to na uniknięcie konieczności precyzyjnego lokalizowania zmian chorobowych w trzonie czy ogonie trzustki.
Jednak w erze chirurgi laparoskopowej, planowanie przedoperacyjne jest dosyć ograniczone w stosunku do samego zabiegu. Przed odkryciem technik minimalnie inwazyjnych, stosunkowo wysoki odsetek wyspiaków (10%) pozostawał niezidentyfikowany.44,45 Ultrasonografia śródoperacyjna (IOUS) jest nieocenionym narzędziem przy realizacji operacji otwartych jak i przy wyłuszczaniu laparoskopowym.15,46 Przy operacji otwartej, kombinacja przedoperacyjnej lokalizacji i śródoperacyjnego badania palpacyjnego oraz IOUS, gwarantują powodzenie udanej resekcji chirurgicznej w praktycznie wszystkich przypadkach (83 – 98%).15,47 W podobny sposób EUS może przekazywać informacje o lokalizacji guza i jego bliskości względem przewodu trzustkowego. W kilku seriach ma czułość w lokalizowaniu wyspiaków większą o 90%. Jest uważane za lepsze badanie przedoperacyjne bo wykrywa małe zmiany, nawet 2-3 mm.15,49-51 Łatwo zorientować się, że w chirurgi laparoskopowej, gdzie nie ma możliwości dotknięcia zmiany, metoda IOUS nabiera jeszcze większego znaczenia. 52-54 Brak laparoskopowej ultrasonografii śródoperacyjnej, pomimo pozytywnej identyfikacji przedoperacyjnej, został uznany jako czynnik częstego powracania do operacji otwartych. 55,56 Należy zauważyć, że choć IOUS ma wyższe wskaźniki wykrywalności niż identyfikacja przedoperacyjna, to pojawiły się przypadki w których nie zlokalizowała tych wykrytych podczas obrazowania przedoperacyjnego.57
Określenie techniki operacyjnej
Chirurgiczne wycięcie insulinomy jest wciąż wybieranym leczeniem.4,13,14 Stosuje się resekcję tradycyjną, resekcję oszczędzającą miąższ lub połączenie tych dwóch metod w zależności od wskazań. Czynniki decydujące o wyborze procedury powinny być ustalone przed operacją. Decyduje o tym diagnoza MEN1, liczba wyspiaków, wielkość guza, złośliwość, lokalizacja w trzustce i anatomiczna bliskość głównego przewodu trzustkowego oraz dużych naczyń krwionośnych. Jak już wcześniej wspomniano większość wyspiaków występuje sporadycznie, pojedynczo i są one łagodne. W związku z tym stosuje się zabiegi oszczędzające miąższ jak wyłuszczenie. Inną strategię leczenia stosuje się u pacjentów z MEN1, ze względu na regularne występowanie zmian wieloogniskowych.
Operacja otwarta, czy laparoskopia ?
W ciągu ostatnich dwóch dekad stosowano w techniki minimalnie inwazyjne z różnym powodzeniem.51,58-61 Wyspiaki stanowią jednak odrębną kategorię, gdyż większość z nich jest łagodna, pojedyncza i małych rozmiarów w momencie rozpoznania (< 2cm). Dlatego są one bardziej podatne na leczenie laparoskopowe niż inne guzy. Pomimo iż są najczęstszymi nowotworami trzustki, to i tak pozostają rzadkimi przypadkami. Nawet największe centra medyczne mają ograniczoną liczbę takich przypadków i leczenia ich laparoskopowo.51,57,60,62 Z tego co wiemy, nie wykonano badań porównujących leczenie wyspiaków laparoskopowo i poprzez operację otwartą. Jest to utrudnione ze względu na niedostatek przypadków. Większość raportów ma charakter retrospektywny, stąd pewne ograniczenia. 56,57,59,63 Ze względu na stosunkowo niewielką liczbę przypadków istnieje trudność w wykazaniu różnic w ważnych kwestiach, jak np., powikłania pooperacyjne.19 Badania wieloośrodkowe borykają się z problemem również ze względu na zmienność stosowanych badań przedoperacyjnych oraz znajomość fachowej wiedzy dotyczącej zaawansowanych technik laparoskopowych.64 Dodatkowo niejednorodność badań sprawia, że porównanie operacji otwartej i laparoskopii jest problematyczne.65 W niektórych badaniach prowadzonych na dużą skalę, występowanie dodatkowych patologii trzustki sprawia, że uogólnienie wyników jest trudne.59,66-68 Ponadto ze względu na to, że badania nie zostały przeprowadzone losowo zarzuca się im stronniczość. Godny uwagi jest również fakt, że laparoskopowe usuwanie nowotworów trzustki jest dziedziną wciąż rozwijającą się. Większość opublikowanych badań zostało przeprowadzonych w instytucjach, ze sporym oświadczeniem w dziedzinie chirurgii guzów neuroendokrynnnych, mających dostęp do zaawansowanych technik laparoskopowych i różnych przed- i śród-operacyjnych procedur diagnostycznych. W związku z tym, nie wiadomo czy wyniki tych badań można odnieść do innych instytucji, gdzie stosuje się otwartą chirurgię trzustki i inne zabiegi laparoskopowe.
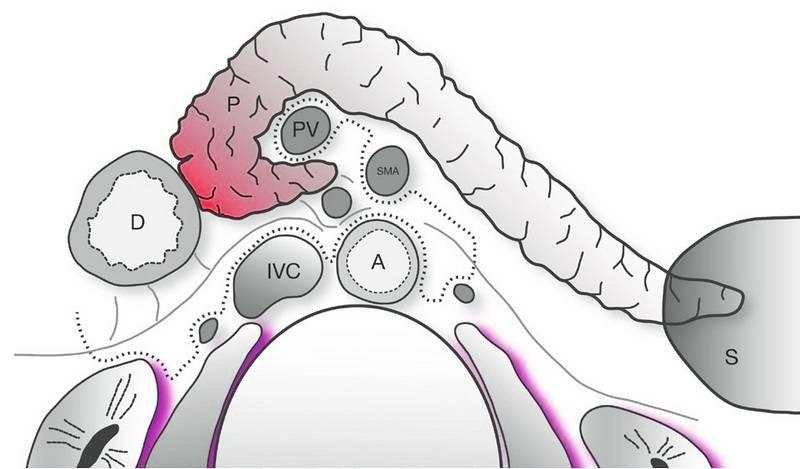
W praktyce operacja trzustki z różnych powodów nie należy do technicznie najłatwiejszych. Jej położenie zaotrzewnowe, bliskość dużych naczyń oraz bardzo delikatna struktura czynią ją niezwykle podatną na uszkodzenia (Ilustracja 3). Laparoskopia daje duże możliwości jeśli chodzi o precyzję, łatwiejsze jest ominięcie sąsiadujących struktur. Oczywiście wymaga to dużego doświadczenia operatora, zdobytego podczas otwartych operacji i odpowiednich umiejętności, w szczególności ważna jest zręczność. Warto zauważyć, że strategia operacyjna jest bardzo podobna w przypadku otwartej operacji jak i laparoskopii.
Podsumowując, z wcześniejszych badań można wywnioskować, że laparoskopowe leczenie wyspiaków jest możliwe i bezpieczne w klinikach, gdzie odnotowano dużą ilość przypadków leczenia guzów neuroendokrynnych. Przeprowadzenie badań losowych jest trudne ze względu na rzadkie występowanie choroby.
Ilustracja 3: Przekrój poprzeczy wskazujący anatomiczne ułożenie trzustki względem innych narządów. P – trzustka; D – dwunastnica; PV – żyła wrotna; IVC – żyła główna dolna; A – aorta brzuszna ;SMA – tętnica krezkowa górna; S – śledziona.
Rodzaje operacji laparoskopowych
Pierwszą operację laparoskopową podczas której wycięto insulinomę przeprowadzono 20 lat temu, wykazała że laparoskopowe wycięcie wyspiaków jest możliwe i bezpieczne.61 Od tamtej pory wysoko wyspecjalizowane ośrodki podnosiły kwalifikacje w zakresie zaawansowanych technik laparoskopowych w chirurgi trzustki. Jednak nie wszystkie zabiegi można było wykonać laparoskopowo.51,57,62,69 Pankreatoduodenektomia ze względu na swoją kompleksowość, w wyspecjalizowanych klinikach prezentuje bardzo dobre wyniki w porównaniu z operacją otwartą.70,71 W rezultacie, w dużych klinikach zabiegi laparoskopowe stały się podstawą leczenia chirurgicznego, ze względu na kilka czynników, m in. krótszą rekonwalescencję i względy estetyczne. Większość przykładów takich zabiegów, opisywanych w literaturze, przedstawia wyłuszczenie pojedynczych zmian, umieszczonych w trzonie lub ogonie trzustki z zachowaniem lub wycięciem śledziony.51,59,62 Niedawna meta-analiza badań prowadzonych na wysoką skalę wykazuje, że ok 65% zabiegów zakończyło się wyłuszczeniem, a w ok. 35% zastosowano częściowe obwodowe wycięcie trzustki.19 W tym miejscu skupimy się na zabiegu wyłuszczenia insulinomy z wycięciem śledziony. W przypadku MEN1 konieczne jest zastosowanie innych metod chirurgicznych, ze względu na omówione już wcześniej powody. MEN1 związana z wyspiakami ma wysoki potencjał choroby nowotworowej, w dużym stopniu występują guzy endokrynne. Jednak kilka operacji pokazało, że zabiegi mało inwazyjne mogą je usunąć z zadowalającym rezultatem, w porównaniu do operacji otwartych.51,69,72
Aktualne wytyczne dotyczące leczenia wyspiaków stanowczo zalecają wyłuszczanie guzów sporadycznych, występujących pojedynczo o średnicy <2 cm widocznej podczas IOUS, gdy stwierdzona jest spójna struktura przewodu trzustki.14 Podczas próby wyłuszczenia należy zachować odległość 2-3 mm od przewodu trzustkowego, odległość weryfikuje podgląd na IOUS.13,73,74 Większe guzy, do 3 cm niosą za sobą większe ryzyko nowotworowe i wzrost wskaźników powikłań.57,59,75 Wcześniejsze raporty donoszą o pomyślnym zastosowaniu technik laparoskopowych w leczeniu sporadycznie występujących wyspiaków, znajdujących się w szczególności w trzonie lub ogonie trzustki.51,60,62,69 Obawy dające podstawę do rozważań na temat (leczenia insulom za pomocą wyłuszczenia) dotyczą powikłań (w ok. 64% może wystąpić przetoka).76,77 Przegląd literatury wykazuje, że wyłuszczenie laparoskopowe, gdy jest stosowane u wybranych pacjentów, u których ten zabieg jest technicznie wykonalny, może wiązać się z wystąpieniem tradycyjnych powikłań.51,57,63,71 Najczęściej występującym powikłaniem jest powstanie przetoki trzustkowej (7,2 % we wszystkich rodzajach zabiegów laparoskopowych), w większości występuje po laparoskopowym wyłuszczeniu.19 Wskaźniki występowania przetoki trzustkowej po laparoskopowym wyłuszczeniu, dla różnych patologii są zmienne (13 – 56%), mogą być uzależnione od lokalizacji guza i jego patologii.66,68,77 We wcześniejszych raportach, bliskość dużych naczyń, jak żyła wrotna uznano za przeciwwskazanie do laparoskopowego wyłuszczenia.19 Ostatnie doniesienia wskazują, że możliwe jest wyłuszczenie laparoskopowe nawet w niebezpiecznych miejscach anatomicznych. Oznacza to, że liczba przeciwwskazań do leczenia laparoskopowego maleje.78
Tradycyjne wyłuszczenie stosuje się w przypadku pojedynczych wyspiaków znajdujących się w bezpiecznej odległości od przewodu trzustkowego. Częściowe obwodowe wycięcie trzustki czy całkowite wycięcie trzustki z dwunastnicą wykonywane są w przypadku MEN1, ze względu na wieloogniskowość i obecność innych guzów endokrynnych mogących przerodzić się w nowotwór.
Laparoskopowa operacja z zachowaniem śledziony zdobywa miano bezpiecznej procedury.69,79,80 Istnieją dwie metody leczenia z zachowaniem śledziony i wycięciem naczyń lub jej całkowitym wycięciem. Ze względu na niezwykle łagodny charakter insulinomy, jako pierwszą metodę zaleca się jej zachowanie.80,83 To czy będzie funkcjonować po wycięciu naczyń zależy od przepływu krwi w krótkich naczyniach żołądka.
W dalszej części pokrótce nakreślimy względy techniczne mające znaczenie podczas podejmowania decyzji o wyłuszczaniu czy częściowym obwodowym wycięciu.
Aspekty techniczne
Insulinomy trzonu lub ogona trzustki
Insulinomy są zwykle niewielkie i mają zwartą konsystencję, wyraźnie widać płaszczyznę guza.27 Ważne jest by usunąć guz w całości by zapobiec jego odbudowie. Gdy guz zostanie zlokalizowany, a jego odległość od przewodu trzustkowego ustalona należy podjąć decyzję, czy wyłuszczyć guz czy zastosować częściowe wycięcie trzustki. Guzy znajdujące się w przedniej lub dolnej części trzustki są łatwiejsze do usunięcia, te znajdujące się z tyłu lub na górze wiążą się z naruszeniem trzonu i ogona trzustki. Tak, więc jeśli guz jest widoczny na przedniej części można zastosować wyłuszczenie (Ilustracja 4). Jeśli insulinoma jest schowana, należy delikatnie naciąć tkanki powyżej guza i dopiero wtedy go wyłuszczyć, uważając by nie uszkodzić przewodu trzustkowego. W przypadku uszkodzenia tylnej powierzchni, unoszony jest dolny brzeg trzonu trzustki i po zabezpieczeniu żyły śledzionowej podejmuje się próbę oddzielenia guza. Zdarza się, że wyłuszczenie jest możliwe tylko poprzez nacięcie szyi w miejscu gdzie znajduje się guz. Podczas zabiegu tego typu należy unikać uszkodzenia tętnicy śledzionowej. Po wyłuszczeniu należy sprawdzić czy nie został uszkodzony przewód trzustki. Guzy położone daleko w okolicy śledziony są szczególnie trudne do zlokalizowania. W przypadku gdy metody wizualizacyjne i ultradźwięki zawodzą stosuje się badanie palpacyjne gruczołu.
Ilustracja 4: Wycięcie insulinomy znajdującej się na dolnej granicy trzonu trzustki.
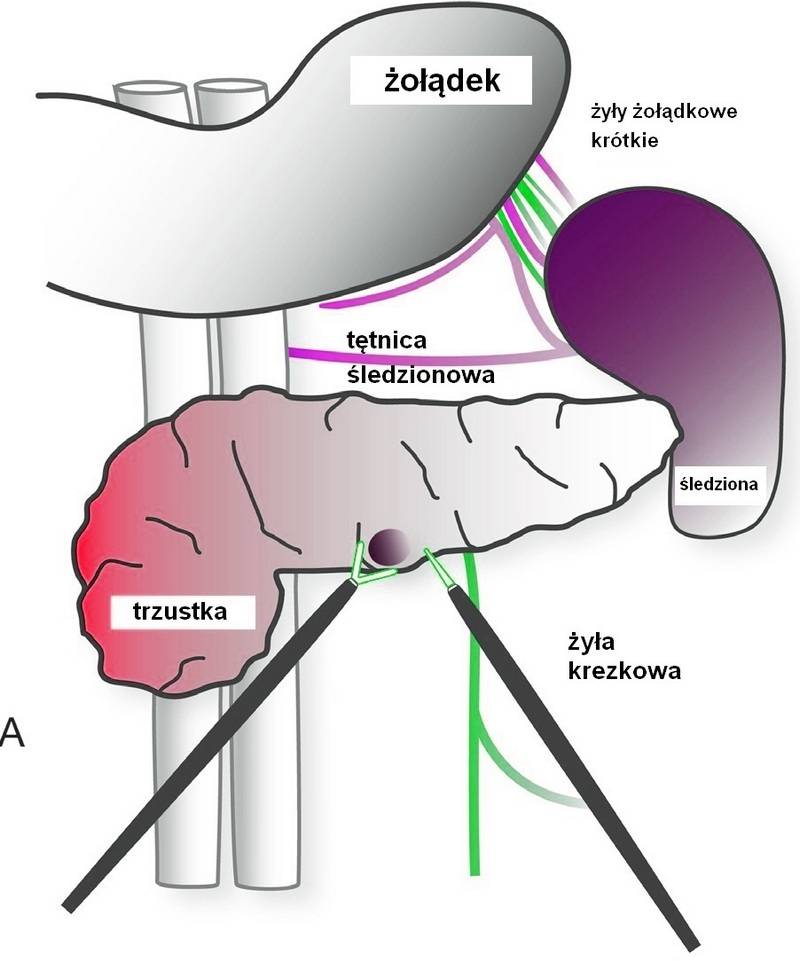
Wyspiaki ulokowane w dalszej części ogona trzustki lub w bardzo bliskim sąsiedztwie głównego przewodu trzustkowego (<3mm) wymagają częściowego obwodowego wycięcia trzustki.13 Technika laparoskopowa tego zabiegu różni się w zależności od tego w jakim ośrodku jest wykonywana i przez jakiego chirurga. Częściowe wycięcie obwodowe może łączyć się z wycięciem śledziony, zachowaniem tylko jej naczyń lub całkowitym jej zachowaniem (Ilustracje 5 i 6). Główne naczynia to żyła krezkowa górna (SMV), żyły i tętnice śledziony, tętnica wątrobowa i żyła krezkowa dolna. Preparowanie zaczyna się od środkowej części ogona trzustki i należy je kontynuować przyśrodkowo do prawej strony ujścia żyły śledzionowej do żyły krezkowej górnej. Wszystkie gałęzie tętnicy śledzionowej powinny zostać zaklipsowane lub podwiązane. Ważne jest też by nie uszkodzić tętnicy wątrobowej podczas podwiązywania tętnicy śledzionowej. Naczynia śledziony można połączyć z trzustką, w zależności od grubości jej miąższu, z wykorzystaniem staplerów liniowych.
Ilustracja 5: Częściowe obwodowe wycięcie trzustki z zachowaniem naczyń śledziony.
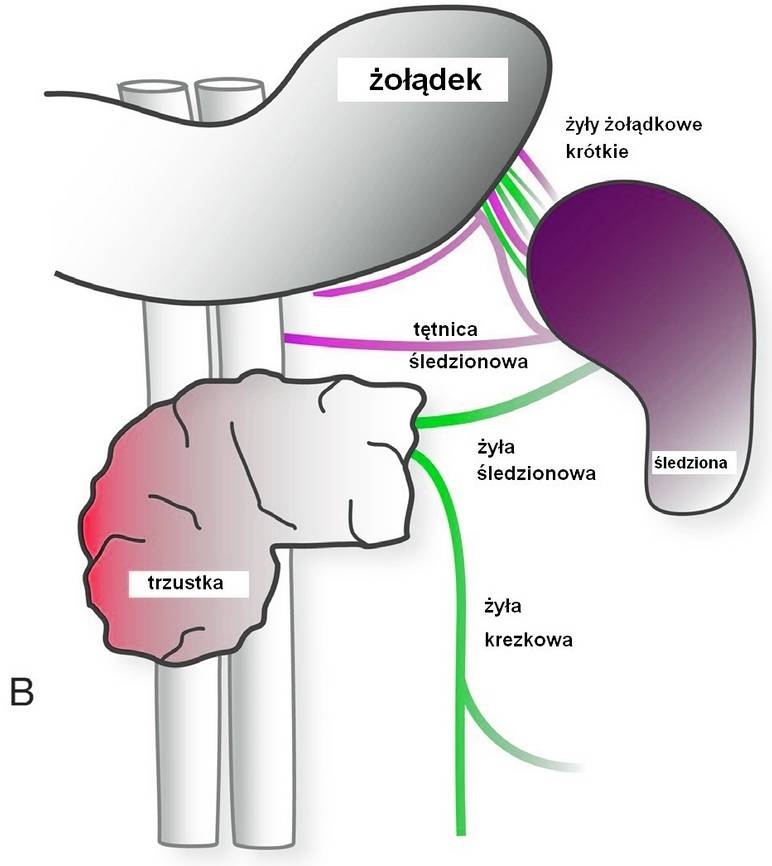
Ilustracja 6:Częściowe obwodowe wycięcie trzustki z wycięciem naczyń śledziony.
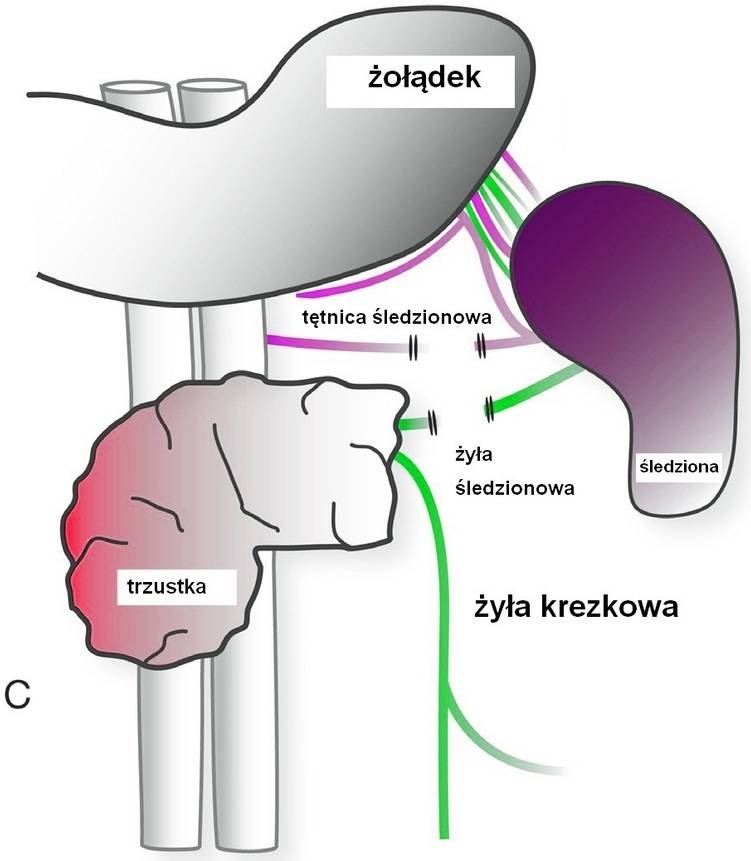
Przy łagodnych guzach trzustki zachowanie śledziony jest standardem, jednak jest to zabieg wymagający dużej sprawności technicznej.
1996 roku Y. Kimura opisał metodę częściowej resekcji trzustki z zachowaniem śledziony, jej tętnic i żył.82 Wcześniej w roku 1988 A. L. Warshaw opisał tę technikę z usunięciem naczyń śledziony.81 Podczas tych operacji należy zachować szczególną ostrożność by nie uszkodzić naczyń żołądka. Po usunięciu części dolnej trzustki jest możliwe zobaczenie jej tylnej powierzchni. SMV zaliczono jako żyłę należącą do śledziony. Naczynia śledziony muszą być wycięte obwodowo i starannie oddzielone od trzustki. Przy technice Warshawa naczynia śledziony poddaje się ligacji. Po tej procedurze jedyny dopływ krwi do śledziony prowadzony jest przez żołądek i jego naczynia. Lewa tętnica żołądkowa pełni ważną rolę w zapobieganiu pooperacyjnego niedokrwienia śledziony.
Oczywiste jest, że po operacji trzeba kontrolować przepływ krwi do śledziony i w razie jej niedokrwienia usunąć.
Insulinomy głowy trzustki
Wycięcie insulinomy z głowy trzustki jest technicznie bardziej wymagające. Wykonuje się rozszerzony manewr Kochera, dzięki czemu cała głowa może zostać uwidoczniona. Po odpowiednim czasie wykonuje się IOUS. Ma to na celu zlokalizowanie guza oraz jego położenie w stosunku do głównego przewodu trzustkowego i SMV. W przypadku guzów głowy trzustki badanie manualne można wykonać pod prawym żebrem. Wyłuszczanie z tylnej powierzchni głowy trzustki wymaga naruszenia prawego płata wątroby i prawej nerki. Zmiany w przedniej części głowy wymagają identyfikacji naczyń krwionośnych. W przypadku zmian zlokalizowanych wzdłuż dolnego brzegu głowy, głowę należy oddzielić od żyły wrotnej i SMV, a małe naczynia boczne poddać ligacji. W przypadku guzów zlokalizowanych wzdłuż górnej krawędzi głowy należy oddzielić tętnicę wątrobową od górnej granicy trzustki. Naczynia są uszczelniane laparoskopowo lub za pomocą diatermii. Po każdej tego typu operacji miejsce wycięcia guza jest starannie sprawdzane, także pod kątem przepływu krwi w naczyniach.
PODSUMOWANIE
Insulinomy są rzadkimi guzami trzustki, które najczęściej występują sporadycznie. Mają one zazwyczaj charakter łagodny przez co nadają się do wycięcia chirurgicznego. Z operacyjnego punktu widzenia kluczowe znaczenie ma lokalizacja guza. Udana lokalizacja guza przed operacją eliminuje konieczność wykonywania operacji na ślepo. Jednakże co do wyboru metody przed-operacyjnie lokalizującej guz konsensus nie został osiągnięty. O wyborze danej metody decyduje zazwyczaj jej dostępność. Przez ostatnie dwie dekady nastąpił postęp technik mało-inwazyjnych, co pozwoliło na zastosowanie leczenia laparoskopowego. Wyniki takich operacji były zadowalające i porównywalne do tych osiąganych poprzez stosowanie otwartych operacji. Jednak brak losowo przeprowadzonych badań na ten temat może podważać to stwierdzenie. Kolejne wątpliwości dotyczą klinik w których przeprowadzano takie badania, specjalizowały się one w chirurgicznym usuwaniu trzustki i prowadzeniu innych zaawansowanych zabiegów laparoskopowych. Z technicznego punktu widzenia te same powody, które dyktują otwarte chirurgiczne leczenie tych guzów są również stosowane do leczenia laparoskopowego. Obecnie twierdzi się, że laparoskopowe usunięcie wyspiaków jest bezpieczne w dużych klinikach specjalizujących się w chirurgi laparoskopowej trzustki. Zastosowanie badania przed – czy śród-operacyjnego jest konieczne z punktu widzenia operacji laparoskopowej. Jak w przypadku innych zaawansowanych zabiegów laparoskopowych, zdobywanie cennej wiedzy i doświadczenia dotyczącego tej metody leczenia uczynią ją z pewnością bardziej powszechną.
Żródła: Metz DC, Jensen RT, 2008 Gastrointestinal neuroen-docrine tumors: pancreatic endocrine tumors. Gastro-enterology 135: 1469-1492.,Halfdanarson TR, Rubin J, Farnell MB, Grant CS, Petersen GM, 2008 Pancreatic endocrine neoplasms: epidemiology and prognosis of pancreatic endocrine tumors. Endocr Relat Cancer 15: 409-427.,Lam KY, Lo CY, 1997 Pancreatic endocrine tumour: a 22-year clinico-pathological experience with mor-phological, immunohistochemical observation and a review of the literature. Eur J Surg Oncol 23: 36-42.,Service FJ, McMahon MM, O’Brien PC, Ballard DJ, 1991 Functioning insulinoma—Incidence, recurrence, and long-term survival of patients: a 60-year study. Mayo Clin Proc 66: 711-719.,Jensen RT, Berna MJ, Bingham DB, Norton JA, 2008 Inherited pancreatic endocrine tumor syndromes: ad-vances in molecular pathogenesis, diagnosis, manage-ment, and controversies. Cancer 113: 1807-1843.,Demeure MJ, Klonoff DC, Karam JH, Duh QY, Clark OH, 1991 Insulinomas associated with multiple endo-crine neoplasia type I: the need for a different surgical approach. Surgery 110: 998-1004.,Vaidakis D, Karoubalis J, Pappa T, Piaditis G, Zografos GN, 2010 Pancreatic insulinoma: current issues and trends. Hepatobiliary Pancreat Dis Int 9: 234-241.,Bartsch DK, Albers M, Knoop R, Kann PH, Fendrich V, Waldmann J, 2013 Enucleation and limited pancreatic resection provide long-term cure for insulinoma in mul-tiple endocrine neoplasia type 1. Neuroendocrinology 98: 290-298.,de Herder WW, Niederle B, Scoazec JY, et al, 2006 Well-differentiated pancreatic tumor/carcinoma: insu-linoma. Neuroendocrinology 84: 183-188., Placzkowski KA, Vella A, Thompson GB, et al, 2009 Secular trends in the presentation and management of functioning insulinoma at the Mayo Clinic, 1987-2007. J Clin Endocrinol Metab 94: 1069-1073., Boukhman MP, Karam JH, Shaver J, Siperstein AE, Duh QY, Clark OH, 1998 Insulinoma-experience from 1950 to 1995. West J Med 169: 98-104., Mathur A, Gorden P, Libutti SK, 2009 Insulinoma. Surg Clin North Am 89: 1105-1121., Jensen RT, Cadiot G, Brandi ML, et al, 2012 ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes. Neuroendo-crinology 95: 98-119., Kulke MH, Anthony LB, Bushnell DL, et al, 2010 NANETS treatment guidelines: well-differentiated neuroendocrine tumors of the stomach and pancreas. Pancreas 39: 735-752., Goh BK, Ooi LL, Cheow PC, et al, 2009 Accurate preoperative localization of insulinomas avoids the need for blind resection and reoperation: analysis of a single institution experience with 17 surgically treated tumors over 19 years. J Gastrointest Surg 13: 1071-1077., Kuzin NM, Egorov AV, Kondrashin SA, Lotov AN, Kuznetzov NS, Majorova JB, 1998 Preoperative and intraoperative topographic diagnosis of insulinomas. World J Surg 22: 593-597; discussion 7-8., Lo CY, Tam PK, 2003 Laparoscopic pancreatic resection of an insulinoma in a child. Asian J Surg 26: 43-45., An L, Li W, Yao KC, et al, 2011 Assessment of contrast-enhanced ultrasonography in diagnosis and preoperative localization of insulinoma. Eur J Radiol 80: 675-680., Mehrabi A, Fischer L, Hafezi M, et al, 2014 A systematic review of localization, surgical treatment options, and outcome of insulinoma. Pancreas 43: 675-686., Gouya H, Vignaux O, Augui J, et al, 2003 CT, en-doscopic sonography, and a combined protocol for preoperative evaluation of pancreatic insulinomas. AJR Am J Roentgenol 181: 987-992., Nikfarjam M, Warshaw AL, Axelrod L, et al, 2008 Improved contemporary surgical management of in-sulinomas: a 25-year experience at the Massachusetts General Hospital. Ann Surg 247: 165-172., Zhang T, Mu Y, Qu L, et al, 2012 Accurate combined preoperative localization of insulinomas aid the choice for enucleation: a single institution experience over 25 years. Hepatogastroenterology 59: 1282-1285., Tamm EP, Bhosale P, Lee JH, Rohren EM, 2016 State-of-the-art imaging of pancreatic neuroendocrine tumors. Surg Oncol Clin N Am 25: 375-400., Druce MR, Muthuppalaniappan VM, O’Leary B, et al, 2010 Diagnosis and localisation of insulinoma: the value of modern magnetic resonance imaging in conjunction with calcium stimulation catheterisation. Eur J Endocrinol 162: 971-978., Thoeni RF, Mueller-Lisse UG, Chan R, Do NK, Shyn PB, 2000 Detection of , functional islet cell tumors in the pancreas: selection of MR imaging sequences for optimal sensitivity. Radiology 214: 483-490., Mirallie E, Pattou F, Malvaux P, et al, 2002 Value of endoscopic ultrasonography and somatostatin recep-tor scintigraphy in the preoperative localization of insulinomas and gastrinomas. Experience of 54 cases. Gastroenterol Clin Biol 26: 360-366., Grant CS, 2005 Insulinoma. Best Pract Res Clin Gas-troenterol 19: 783-798., Brown CK, Bartlett DL, Doppman JL, et al, 1997 Intraarterial calcium stimulation and intraoperative, ultrasonography in the localization and resection of insulinomas. Surgery 122: 1189-1193; discussion 93-94., Winter TC, 3rd, Nghiem HV, Freeny PC, Hommeyer SC, Mack LA, 1995 Hepatic arterial anatomy: dem-onstration of normal supply and vascular variants with three-dimensional CT angiography. Radiographics 15: 771-780.,Dravecka I, Lazurova I, 2014 Nesidioblastosis in adults. Neoplasma 61: 252-256., Thompson SM, Vella A, Thompson GB, et al, 2015 Selective Arterial Calcium Stimulation With Hepatic Venous Sampling Differentiates Insulinoma From Ne-sidioblastosis. J Clin Endocrinol Metab 100: 4189-4197., Guettier JM, Kam A, Chang R, et al, 2009 Localization of insulinomas to regions of the pancreas by intraarte-rial calcium stimulation: the NIH experience. J Clin Endocrinol Metab 94: 1074-1080., Anderson MA, Carpenter S, Thompson NW, Nostrant TT, Elta GH, Scheiman JM, 2000 Endoscopic ultra-sound is highly accurate and directs management in patients with neuroendocrine tumors of the pancreas. Am J, Gastroenterol 95: 2271-2277., Tellez-Avila FI, Acosta-Villavicencio GY, Chan C, et al, 2015 Diagnostic yield of endoscopic ultrasound in patients with hypoglicemia and insulinoma suspected. Endosc Ultrasound 4: 52-55., Puli SR, Kalva N, Bechtold ML, et al, 2013 Diagnos-tic accuracy of endoscopic ultrasound in pancreatic neuroendocrine tumors: a systematic review and meta analysis. World J Gastroenterol 19: 3678-3684., Kann PH, 2016 Endoscopic Ultrasound in Endocri-nology: Imaging of the Adrenals and the Endocrine Pancreas. Front Horm Res 45: 46-54., Sotoudehmanesh R, Hedayat A, Shirazian N, et al, 2007 Endoscopic ultrasonography (EUS) in the localization of insulinoma. Endocrine 31: 238-241., Joseph AJ, Kapoor N, Simon EG, et al, 2013 Endoscopic ultrasonography–a sensitive tool in the preoperative localization of insulinoma. Endocr Pract 19: 602-608., Leelasinjaroen P, Manatsathit W, Berri R, Barawi M, Gress FG, 2014 Role of preoperative endoscopic ultra-sound-guided fine-needle tattooing of a pancreatic head insulinoma. World J Gastrointest Endosc 6: 506-509.,Newman NA, Lennon AM, Edil BH, et al, 2010 Pre-operative endoscopic tattooing of pancreatic body and tail lesions decreases operative time for laparoscopic distal pancreatectomy. Surgery 148: 371-377., Zografos GN, Stathopoulou A, Mitropapas G, et al, 2005 Preoperative imaging and localization of sized insulinoma with EUS-guided fine needle tattoing: a case report. Hormones (Athens) 4: 111-116., Zografos GN, Vasiliadis G, Karoubalis J, Tsagarakis S, 2010 Laparoscopic resection of insulinoma after endoscopic ultrasonography tattooing. Am Surg 76: 446-448.
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny











Więcej
Czy ludzie agresywni powinni być izolowani i co się dzieje z ich mózgiem?
Czy Polsce grozi epidemia Ćpunów?
Ci ludzie są tak głupi a może tak mądrzy albo chorzy?