Ostatnia aktualizacja 28 lipca 2022
Krwawienie z przewodu pokarmowego jest bardzo istotnym problemem klinicznym. Częstość hospitalizacji z powodu krwawienia z górnego odcinka przewodu pokarmowego ocenia się na 36-102 chorych na 100 000 osób rocznie. Dotyczy ono dwukrotnie częściej mężczyzn niż kobiet.Krwawienie z dolnego odcinka przewodu pokarmowego jest powodem przyjęcia do szpitala ok. 20 chorych na 100 000 osób rocznie. Przewlekłe stosowanie niesteroidowych leków przeciwzapalnych przyczynia się do zwiększenia częstości tych krwawień. Jednakże w ciągu ostatnich 10 lat odnotowano skrócenie czasu hospitalizacji, co wiąże się z rozwojem metod diagnostycznych i endoskopowych metod hemostatycznych.Śmiertelność z powodu krwawień z górnego odcinka przewodu pokarmowego wynosi 3,5‑14%, zaś wywołana krwawieniem z dolnego odcinka przewodu pokarmowego ok. 3‑5%.W niniejszym artykule omówione zostały etiopatogeneza,diagnostyka i leczenie krwawień z górnego odcinka przewodu pokarmowego pochodzenia nieżylakowego wywołanych żylakami przełyku, z dolnego odcinka przewodu pokarmowego oraz tzw. krwawień utajonych.
KRWAWIENIA Z GÓRNEGO ODCINKA PRZEWODU POKARMOWEGO POCHODZENIA NIEŻYLAKOWEGO
Krwawienie z górnego odcinka przewodu pokarmowego(GOPP) to krwawienie, którego źródło znajduje się w przełyku, żołądku lub dwunastnicy (powyżej więzadła Treitza). Klinicznie manifestuje się fusowatymi lub krwistymi wymiotami i/lub smolistymi lub krwistymi stolcami. Obecność fusowatych wymiotów świadczy zazwyczaj o większej intensywności krwawienia niż w przypadku występowania wyłącznie smolistych stolców. Należy również zaznaczyć, że występowanie krwistych stolców przy źródle krwawienia w GOPP świadczy o jego większym nasileniu.
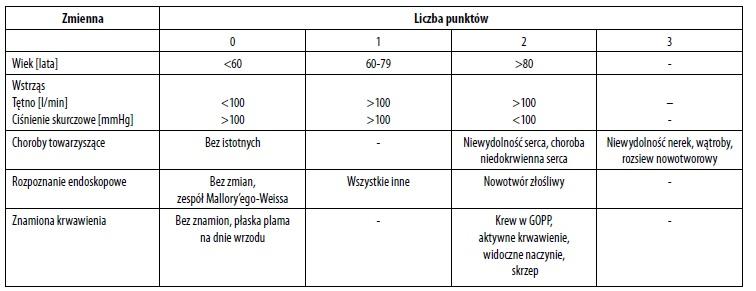
Tabela 1. Skala Rockalla określająca ryzyko nawrotu krwawienia z GOPP i zgonu.
Nawrotem krwawienia określa się ponowne wystąpienie wyżej wymienionych objawów z towarzyszącą tachykardią lub spadkiem ciśnienia tętniczego i/lub spadek stężenia hemoglobiny o 2 g/dl w ciągu doby. Najczęstszymi przyczynami krwawienia z GOPP są wrzody dwunastnicy (25,0%), wrzody żołądka (15,9%), zapalenie nadżerkowe (15,4%), żylaki przełyku i żołądka (10,5%), zapalenie przełyku (7,4%), zespół Mallory’ego-Weissa (6,1%), nowotwory (2,3%). Przyczyny krwawienia nie udaje się początkowo wyjaśnić u 3‑20% pacjentów.
Wstępne postępowanie przy przyjęciu pacjenta z krwawieniem z GOPP do szpitala polega na ocenie ciężkości krwawienia, suplementacji płynów i przeprowadzeniu niezbędnych badań laboratoryjnych (w tym m.in. morfologii krwi obwodowej, grupy krwi, próby zgodności serologicznej, koagulogramu). Ocena ciężkości krwawienia i prognozowanie jego przebiegu ma duże znaczenie w wyborze optymalnej terapii, pilności przeprowadzenia endoskopii czy intensywności monitorowania pacjenta. W tym celu wykorzystywana jest skala Rockalla (tabela 1). Początkowo wyliczana jest ocena prognostyczna przed wykonaniem endoskopii, co wymaga uwzględnienia wieku chorego, współistniejących chorób oraz pomiaru częstości tętna i ciśnienia tętniczego. Ocena 0 wiąże się z bardzo dobrym rokowaniem, natomiast ocena wyższa niż 7 jest równoznaczna z wysokim (ok. 50%) ryzykiem zgonu chorego. Chorzy z oceną 0‑2 punkty mogą być hospitalizowani na oddziale internistycznym i poddani endoskopii w ciągu najbliższych 24 godzin. Pacjenci z oceną >3 punktów powinni być poddani endoskopii w trybie pilnym, natychmiast po wyrównaniu zaburzeń hemodynamicznych.
W początkowej fazie leczenia najistotniejszym zadaniem jest uzupełnianie płynów i wyrównanie zaburzeń hemodynamicznych (utrzymanie prawidłowej wartości tętna i ciśnienia tętniczego). Wszyscy chorzy powinni mieć zapewniony dostęp do żyły obwodowej, monitorowane ciśnienie tętnicze, tętno i diurezę oraz nie przyjmować żadnych pokarmów doustnie.
Wypełnienie łożyska naczyniowego uzyskuje się zwykle po przetoczeniu ok. 2000 ml płynu. Należy również zaznaczyć, że stężenie hemoglobiny we wczesnym etapie krwawienia z GOPP zazwyczaj nie w pełni odzwierciedla rzeczywistą aktywność krwawienia. Czynnikiemwpływającym na podjęcie decyzji o przeprowadzeniu transfuzji są choroby współistniejące (np. niewydolność krążenia), obecność krwistych wymiotów lub krwistych stolców, objawy wstrząsu, tachykardia >120/min, tachypnoe>30 oddechów/min.
Postępowanie przed wykonaniem endoskopii u chorych z krwawieniem z GOPP powinno obejmować również parenteralne leczenie inhibitorami pompy protonowej (IPP) pod postacią jednorazowego dożylnego podania leku w dawce 80 mg. Udowodniono, że działanie to zmniejsza odsetek chorych aktywnie krwawiących podczas endoskopii, redukuje konieczność stosowania endoskopowych zabiegów hemostatycznych oraz zmniejsza częstość nawrotów krwawienia. Ponadto chorym, u których wykonuje się endoskopię w trybie pilnym wskazane jest podanie erytromycyny w dawce 3 mg/kg m.c. w jednorazowym wstrzyknięciu dożylnym. Erytromycyna posiada właściwości gastrokinetyczne, przez co powoduje opróżnienie żołądka z krwi skrzepów i ułatwia przeprowadzenie endoskopii.
Endoskopię w krwawieniu z GOPP można wykonać w trybie pilnym lub elektywnym przyspieszonym (w ciągu 24 godzin od przyjęcia do szpitala). Decyzja o trybie przeprowadzenia zabiegu podejmowana jest na podstawie oceny ciężkości krwawienia – przy uzyskaniu 3 lub więcej punktów w skali Rockalla wskazana jest endoskopia w trybie pilnym. Zabieg endoskopowy powinien być przeprowadzony po ustabilizowaniu parametrów hemodynamicznych (ciśnienie krwi i tętno). W wyjątkowych przypadkach przeprowadza się go u chorych we wstrząsie jako zabieg ratujący życie. Należy również podkreślić, że według zaleceń Polskiego Towarzystwa Gastroenterologicznego (PTG-E) endoskopia powinna być przeprowadzona w specjalnie przygotowanym ośrodku dysponującym przeszkolonym personelem i odpowiednimi akcesoriami endoskopowymi umożliwiającymi tamowanie krwawienia. W przypadkach szczególnie ciężkich krwawień endoskopia może być wykonana przy łóżku chorego (np. u osób hospitalizowanych w OIOM) lub na sali operacyjnej przy udziale w badaniu chirurga.

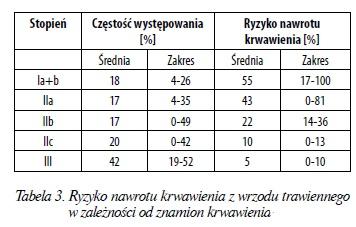
Endoskopia w trybie pilnym powinna być przeprowadzona w analgosedacji lub w znieczuleniu ogólnym dożylnym przy udziale zespołu anestezjologicznego.Postępowanie to umożliwia bardziej precyzyjne i skuteczne przeprowadzenie zabiegów hemostatycznych.Obraz endoskopowy zmiany będącej źródłem krwawienia umożliwia ocenę ryzyka nawrotu krwawienia poprzez określenie obecności tzw. znamion krwawienia opisywanych w klasyfikacji Forresta (tabela 2).Prawdopodobieństwo wystąpienia ponownego krwawienia opartego na klasyfikacji Forresta przedstawiono w tabeli 3. Z analizy tych danych można ustalić,że najbardziej narażeni na ponowne krwawieniesą pacjenci z aktywnym krwawieniem tętniczym lub żylnym oraz z widocznym niekrwawiącym naczyniem krwionośnym. Z kolei chorzy, u których stwierdzono zabarwioną plamę na dnie wrzodu lub czyste dno wrzodu, nie wymagają endoskopowych zabiegów hemostatycznych.Obecność skrzepu w dnie owrzodzenia (Forrest IIb)najczęściej wiąże się z obecnością naczynia krwionośnego pod skrzepem. Sytuacja ta wymaga usunięcia skrzepu po wcześniejszym ostrzyknięciu zmiany roztworem adrenaliny i przeprowadzeniu zabiegów hemostatycznych na widocznym naczyniu krwionośnym.Zabiegi hemostatyczne obejmują metody iniekcyjne,koagulacji kontaktowej i bezkontaktowej oraz mechaniczne.Terapia iniekcyjna oparta jest na ostrzykiwaniu miejsca krwawienia roztworem adrenalinyw soli fizjologicznej w stężeniu 1:10 000 w objętości4‑16 mm w 4 kwadrantach wokół zmiany. Działanie to wywołuje mechaniczny efekt hemodynamiczny oraz obkurczenie krwawiących naczyń poprzez swoiste działanie adrenaliny. W metodzie iniekcyjnej można wykorzystać również inne substancje,np.: 0,9% NaCl, 3,0% NaCl, 50% glukozę, etanol 98%,polidokanol, etanolaminę, tetradecylosiarczan sodu,trombinę, klej fibrynowy lub histoakryl. W wyniku przeprowadzonych analiz nie ustalono jednak wyższej skuteczności hemostatycznej któregokolwiek z powyższych preparatów.
Metody iniekcyjne powodują uzyskanie wczesnej hemostazy u prawie wszystkich chorych,jednakże wiążą się z wysokim odsetkiem nawrotu krwawienia (15‑20%).Metody koagulacji wykorzystują energię elektryczną lub cieplną w celu uzyskania hemostazy. Wśród metod kontaktowych dostępna jest koagulacja jednobiegunowa,dwubiegunowa lub termokoagulacja. W tzw. Koagulacji jednobiegunowej przepływ prądu odbywa się między elektrodą czynną (na końcu cewnika) i bierną(na skórze chorego), uzyskując głęboką penetrację prądu przy wykorzystaniu półsekundowych impulsów elektrycznych o mocy 50‑100 W. Koagulacja dwubiegunowa polega na przepływie prądu między dwiema elektrodami umieszczonymi na końcówce sondy. Wymaga ona jednak wysoce precyzyjnego zlokalizowania krwawiącego naczynia i prostopadłego ustawienia końcówki cewnika. Termokoagulacja natomiast nie wymaga przepływu prądu przez tkanki, lecz wykorzystuje energię termiczną,której źródłem jest pokryty teflonem metalowy cylinder umieszczony na końcu sondy. Wśród metod koagulacji bezkontaktowej wymienia się plazmową koagulację argonową (APC), w której źródłem energii jest strumień zjonizowanego argonu. Znajduje ona zastosowanie w leczeniu krwawiących powierzchownych zmian i umożliwia przeprowadzenie koagulacji niezależnie od kąta ustawienia sondy oraz z większej odległości (2‑8 mm). Metoda ta pozwala na uzyskanie hemostazy w niekorzystnie zlokalizowanych zmianach.Głębokość koagulacji uzależniona jest od mocy prądu (zwykle 40‑50 W), czasu aplikacji prądu (zwykle ok. 2 s) i odległości od zmiany. Koagulacja laserowanie jest praktycznie stosowana ze względu na ograniczoną mobilność cewnika.
Techniki koagulacji pozwalają na uzyskanie hemostazy w podobnym odsetku jak w terapii iniekcyjnej. Udowodniono również, że żadna z metod terapii koagulacyjnej nie wykazuje przewagi nad pozostałymi. Skuteczność APC w osiągnięciu pierwotnej hemostazy wynosi ok. 96% przy odsetku nawrotów krwawienia 17%.Metody koagulacji mechanicznej obejmują stosowanie klipsów hemostatycznych, opasek gumowych lub pętli z tworzywa sztucznego. Klipsy hemostatyczne mogą być stosowane w leczeniu wszystkich typów krwawiących zmian, a w szczególności krwawień tętniczych i widocznych niekrwawiących naczyń. Zaleca się zakładanie klipsów bezpośrednio na krwawiące naczynie oraz na tkanki przylegające do niego. Zabieg ten jest utrudniony w krwawieniach zlokalizowanych na tylnej ścianie opuszki dwunastnicy oraz na tylnej ścianie i krzywiźnie mniejszej żołądka. Do uzyskania hemostazy konieczne jest niejednokrotnie zastosowanie kilku klipsów. Wskazane jest również wcześniejsze ostrzyknięcie zmian roztworem adrenaliny, co ułatwia przeprowadzenie zabiegu. Mimo większych trudności technicznych metody oparte na zakładaniu klipsów hemodynamicznych są najskuteczniejszą metodą endoskopowego tamowania krwawień pozwalającą na uzyskanie początkowej hemostazy u 93% chorych oraz niewielkiego odsetka nawrotów krwawienia – 8%.Należy podkreślić, że w endoskopowym tamowaniu krwawień zaleca się stosowanie kombinacji dwóch metod hemostazy. Szczególnie polecane jest łączenie terapii iniekcyjnej z koagulacją lub hemostazą mechaniczną.Postępowanie endoskopowe w krwawieniu spowodowanym innymi przyczynami niż wrzód trawienny może być odmienne. Sangwinacja w zespole Malloryego-Weissaz reguły ustępuje samoistnie. W przypadku masywnych krwawień można zastosować którąkolwiek z technik hemostatycznych. Malformacje naczyniowe najczęściej zaopatruje się koagulacją APC. Krwawienia z nowotworów GOPP wiążą się z dużym odsetkiem nawrotów(80%), co wiąże się z koniecznością wyboru leczeniac hirurgicznego lub technik radiologii zabiegowej.
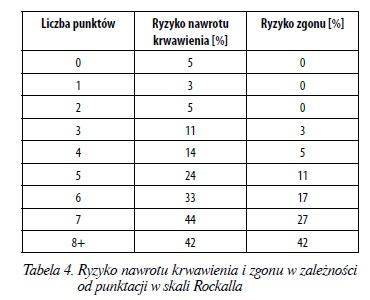
Po przeprowadzeniu endoskopii należy przeprowadzić ponowną ocenę prognostyczną chorego na podstawieskali Rockalla i ustalić dalsze postępowanie dotyczące miejsca hospitalizacji, monitorowania i leczenia farmakologicznego(tabela 4). Wynik 0‑2 punkty wiąże sięz minimalnym ryzykiem nawrotu krwawienia i pozwalana dalsze ambulatoryjne leczenie chorych. Ocena 7 lub wyższa oznacza bardzo wysokie ryzyko nawrotu krwawienia i zgonu oraz wymaga prowadzenia intensywnego nadzoru i leczenia farmakologicznego.
Szczególnie ważnym elementem postępowania w krwawieniach z GOPP jest leczenie farmakologiczne. Jego podstawą są leki antysekrecyjne– inhibitory pompy protonowej (IPP), które powodują wzrost pH w GOPP,co umożliwia stabilizację skrzepu i agregację płytekkrwi. Wykazano jednoznacznie, że IPP są skuteczniejsze niż antagoniści receptora histaminowego H2 w zapobieganiu nawrotom krwawienia z GOPP, zmniejszeniu konieczności leczenia operacyjnego, przetaczania krwi i skróceniu czasu hospitalizacji. Szczególnie korzystny efekt stosowania IPP obserwuje się u chorych z krwawieniem z wrzodu trawiennego. Ponadto zaobserwowano wyższą skuteczność IPP u rasy azjatyckiej niż u rasy kaukaskiej.
Ustalono, że optymalną metodą podania IPP jest dożylny bolus 80 mg, a następnie ciągły wlew preparatu w dawce 8 mg/godzinę przez ok. 72 godziny. Postępowanie to umożliwia ewolucję aktywnego krwawienia do znamion niskiego ryzyka. W grupie chorych z pośrednim ryzykiem wystąpienia nawrotu krwawienia zaleca się stosowanie IPP dożylnie w dawce 40 mgco 12 godzin. Chorzy z niskim ryzykiem nawrotu krwawienia mogą być leczeni IPP doustnie w dawce 40 mg co 12 godzin. Po 5 dniach od wystąpienia krwawienia dopuszczalne jest kontynuowanie leczenia IPP drogą doustną u wszystkich chorych. Należy również zaznaczyć, że nie zaleca się rutynowego stosowania analogów somatostatyny w leczeniu krwawienia z GOPP. Mechanizm działania polega na zmniejszeniu wydzielania gastryny oraz spadku przepływu krwi przez naczynia trzewne. Ich stosowanie może być wskazane u osób, u których nie udaje się zapewnić prawidłowych parametrów hemodynamicznych lub w przypadku niedostępności metod endoskopowych lub istnienia przeciwwskazań do ich przeprowadzenia.
Wykonanie kontrolnej endoskopii po zabiegach tamowania krwawienia nie jest wymagane w większości przypadków. Wyjątek stanowią sytuacje, w których zalegająca krew nie pozwoliła na uwidocznienie błony śluzowej i zlokalizowanie źródła krwawienia oraz w przypadku braku pewności co do skuteczności zastosowanych metod hemostatycznych. W przypadku nawrotu krwawienia z GOPP wskazane jest ponowne przeprowadzenie endoskopowej hemostazy. Postępowanie to obarczone jest mniejszym ryzykiem występowania powikłań, przy podobnej skuteczności niż leczenie chirurgiczne.
W przypadku kolejnego nawrotu krwawienia zaleca się przeprowadzenie zabiegu operacyjnego. W przypadku wystąpienia masywnego krwawienia, w którym niemożliwa jest identyfikacja jego źródła, lub krwawienia z naczyń o dużej średnicy, którego nie da się zatamować metodą endoskopową, możliwe jest przeprowadzenie przezcewnikowej embolizacji naczyń (z reguły tętnicy żołądkowo-dwunastniczej lub żołądkowej lewej) przy użyciu klejów akrylowych, polimeru alkoholu winylowego, spirali lub skrzepu krwi własnej chorego. Postępowanie to umożliwia zatrzymanie krwawienia i ustabilizowanie stanu chorego przed leczeniem chirurgicznym.
Każdy przypadek niepowodzenia endoskopowego tamowania krwawienia z GOPP jest wskazaniem do leczenia operacyjnego. Ponadto postępowanie takie należy zalecić w celu zapobiegania zagrażającemu życiu nawrotowi krwawienia u osób z grupy wysokiego ryzyka zgonu. Odsetek nawrotów krwawienia po leczeniu endoskopowym waha się od 10 do 20%. Ponowne tamowanie krwawienia wiąże się z koniecznością przeprowadzenia leczenia chirurgicznego u 25‑50% chorych, obarczonego śmiertelnością 30‑40%. Dlatego też uważa się, że u osób obarczonych chorobami towarzyszącymi i w przypadku wysokiego ryzyka nawrotu krwawienia powinno się przeprowadzić wczesne leczenie operacyjne. Leczenie operacyjne powinno być oszczędzające, ograniczone do zatamowania krwawienia, miejscowej resekcji wrzodu i podwiązania gałęzi tętnicy żołądkowej lewej (wrzody żołądka) lub tętnicy żołądkowo-dwunastniczej (wrzody dwunastnicy).
Dalsze postępowanie po zakończeniu ostrego okresu choroby polega na podawaniu IPP w dawce 20‑40 mg/dobę doustnie przez 4 tygodnie w przypadku wrzodu dwunastnicy lub 6‑8 tygodni przy wrzodzie żołądka. W przypadku obecności infekcji H. pylori konieczne jest leczenie eradykacyjne, które zapobiega późnym nawrotom krwawienia. Nie ma jednak potrzeby włączania tej terapii w ostrym okresie choroby. W przypadku leczenia krwawienia z wrzodu żołądka konieczne jest przeprowadzenie kontrolnej endoskopii po ok. 6‑8 tygodniach od wykonania zabiegu w celu oceny gojenia wrzodu i wykluczenia jego nowotworowej etiologii. Przy wrzodach dwunastnicy, po eradykacji H. pylori nie jest wymagane kontrolne badanie endoskopowe. Należy podkreślić, że kontrolna endoskopia zalecana jest u wszystkich pacjentów po przebytym krwawieniu z GOPP przyjmujących stale niesteroidowe leki przeciwzapalne (NLPZ).
KRWAWIENIA Z ŻYLAKÓW PRZEŁYKU
Żylaki przełyku są częstym i groźnym powikłaniem nadciśnienia wrotnego, w którym ciśnienie w układzie żyły wrotnej przekracza 12 mm Hg. Jako kryterium nadciśnienia wrotnego przyjmuje się najczęściej gradient ciśnień między żyłą wrotną a żyłą główną dolną (ang. hepaticvenouspressure, HVPG) przekraczający 5‑10 mm Hg. W 90% przypadków przyczyną nadciśnienia wrotnego jest marskość wątroby, która wywołana może być czynnikami przedwątrobowymi (zakrzepica żyły wrotnej, żyły śledzionowej, transformacja jamista żyły wrotnej, przetoka tętniczo-żylna w śledzionie), wewnątrzwątrobowymi przedzatokowymi (schistosomatoza, WZW typu B lub C, pierwotna marskość żółciowa, ogniskowy rozrost guzkowy, sarkoidoza, gruźlica, choroba Wilsona, hemochromatoza, amyloidoza, inne choroby spichrzeniowe, wielotorbielowatość wątroby, infiltracja wnęki wątroby przez zmiany łagodne i złośliwe), zatokowymi (marskość wątroby niezależnie od etiologii), pozazatokowymi (choroba wenookluzyjna, poalkoholowe stwardnienie hialitowe żył środkowych) oraz przyczynami pozawątrobowymi (zespół Budd-Chiariego, nowotwory, niedrożność żyły głównej dolnej, choroby serca, przewlekła niewydolność krążenia, przewlekłe zaciskające zapalenie osierdzia, niewydolność zastawki trójdzielnej).
W chwili rozpoznania marskości wątroby żylaki przełyku stwierdza się u 50% pacjentów, zaś krwawienie występuje u 30‑40% z nich. Stopień zaawansowania marskości wątroby koreluje z odsetkiem występowania żylaków przełyku. W stopniu A wg klasyfikacji Childa-Pugha żylaki stwierdza się u 40% pacjentów, zaś w stopniu C – aż u 85% chorych. Bezpośrednią przyczyną krwawienia z żylaków przełyku może być mechaniczny uraz spowodowany przez połykanie pokarmów oraz przez refluks żołądkowo-przełykowy. Inna, bardziej akceptowana hipoteza zakłada, że głównym czynnikiem związanym z ryzykiem pęknięcia żylaka i wystąpienia krwawienia jest wzrost ciśnienia w układzie żyły wrotnej. Aktualnie stosowane metody leczenia krwawienia z żylaków przełyku umożliwiają uzyskanie hemostazy w 80% przypadków, zaś śmiertelność u tych chorych w ciągu ostatnich 20 lat zmniejszyła się z 40 do 20%.
Diagnostyka żylaków przełyku opiera się przede wszystkim na badaniu endoskopowym. Klasyfikację żylaków przełyku określa endoskopowa skala OMED (franc. OrganisationMondialed’EndoscopieDigestive): I stopień – niewielkie uwypuklenie ściany przełyku przez żylak, II – uwypuklenie sięgające 1/4 obwodu przełyku, III – uwypuklenie nieprzekraczające 1/2 obwodu przełyku, IV – uwypuklenie przekraczające 1/2 obwodu przełyku. Dodatkowe informacje na temat wysokiego ryzyka wystąpienia krwawienia niesie za sobą obecność tzw. czerwonych znamion, takich jak czerwone plamy i pręgi na powierzchni żylaka.
Rozpoznanie krwawienia z żylaków przełyku ułatwia przeprowadzenie badania podmiotowego i przedmiotowego, w których stwierdza się wywiad choroby wątroby i charakterystyczne objawy, takie jak m.in. żółtaczka, wodobrzusze, obrzęki obwodowe. Krwotok z żylaków przełyku manifestuje się zazwyczaj wymiotami krwią lub skrzepami. Smolisty stolec lub fusowate wymioty obserwuje się rzadziej. Niejednokrotnie krwawieniom z żylaków przełyku towarzyszą objawy hipowolemii mogące doprowadzić do wstrząsu. Należy również zaznaczyć, że przyczyną krwawienia z GOPP u chorych z nadciśnieniem wrotnym mogą być również żylaki dna żołądka lub dwunastnicy, gastropatia zastoinowa, ektazja naczyń żołądka – żołądek arbuzowaty czy wrzód dwunastnicy.
Leczenie krwotoków z żylaków przełyku powinno się rozpocząć od wyrównania zaburzeń hemodynamicznych poprzez zapewnienie dostępu do co najmniej dwóch żył obwodowych lub do żyły centralnej i odpowiedniej suplementacji płynów lub preparatów krwiopochodnych. Należy jednak unikać zbyt intensywnego przetaczania płynów ze względu na możliwość nadmiernego wzrostu ciśnienia w układzie żyły wrotnej i nasilenia krwotoku. Zaleca się utrzymanie skurczowego ciśnienia tętniczego w granicach ok. 100 mm Hg. W przypadku obecności zaburzeń krzepnięcia wywołanych niedoborem czynników krzepnięcia lub małopłytkowością wymagane jest również przetoczenie osocza lub koncentratu krwinek płytkowych. Głównym elementem leczenia farmakologicznego jest wczesne stosowanie leków wazoaktywnych (somatostatyna, terlipresyna), które zmniejszają ciśnienie wrotne i zwiększają szansę zatrzymania krwawienia. Somatostatyna jest endogennym hormonem wywołującym skurcz naczyń trzewnych i zmniejszenie przepływu krwi w układzie żyły wrotnej. Stosuje się ją w początkowym bolusie dożylnym (250 μg), a następnie w ciągłym wlewie 250 μg/godzinę przez 5 dni. W przypadku utrzymującego się krwawienia możliwe jest trzykrotne powtórzenie bolusa oraz dwukrotne zwiększenie dawki ciągłego wlewu dożylnego. W terapii krwawienia z żylaków przełyku stosuje się również syntetyczny analog somatostatyny – oktreotyd charakteryzujący się dłuższym biologicznym okresem półtrwania. Terlipresyna jest syntetyczną pochodną wazopresyny, która wywołuje natychmiastowy efekt naczynioskurczowy. Wykazuje dłuższą aktywność biologiczną niż wazopresyna, kurczy naczynia trzewne i zmniejsza przepływ w układzie żyły wrotnej oraz stymuluje krążenie wewnątrzwątrobowe, obniżając opór hemodynamiczny w naczyniach wewnątrzwątrobowych. Zalecane dawkowanie terlipresyny zakłada dożylne podawanie 2 mg leku co 4 godziny przez pierwsze 2 doby, a następnie 1 mg co 4 godziny do 5 dni.
Należy zaznaczyć, że podejmowano próby stosowania rekombinowanego czynnika krzepnięcia krwi VIIa w leczeniu krwawień z żylaków przełyku, jednakże dotychczas nie uzyskano danych potwierdzających korzyści wynikających z tej terapii.
Kolejnym ważnym elementem farmakoterapii krwawienia z żylaków przełyku są antybiotyki. Istotnym czynnikiem prognostycznym u tych chorych jest towarzysząca infekcja bakteryjna występująca w 30‑40% przypadków, manifestująca się spontanicznym bakteryjnym zapaleniem otrzewnej (50%), infekcją układu moczowego (25%) lub zapaleniem płuc (25%). Zakażenie bakteryjne prowadzi do wzrostu ciśnienia wrotnego i przyczynia się do zwiększenia ryzyka wczesnego nawrotu krwawienia i zgonu. Udowodniono, że antybiotykoterapia redukuje śmiertelność i zapobiega infekcjom bakteryjnym u tych chorych. Leczenie należy włączyć już przy przyjęciu do szpitala i kontynuować przez 5‑7 dni. Zaleca się stosowanie antybiotyków z grupy chinologów (ciprofloksacyna2×200 mg i.v. lub norfloksacyna2×400 mg p.o.). Pacjentom z zaawansowaną niewydolnością wątroby zaleca się podawanie cefalosporyny trzeciej generacji – ceftriaksonu w dawce 1 g/dobę.
Podstawową rolę w leczeniu krwawień z żylaków przełyku odgrywają metody endoskopowe. Badanie powinno być przeprowadzone nie później niż 12 godzin od chwili wystąpienia krwawienia. W celu wykonania endoskopowej hemostazy wykorzystuje się metody iniekcyjne (z zastosowaniem substancji sklerotyzującychi klejów tkankowych) oraz metody mechaniczne (z użyciem opasek gumowych oraz pętli odłączanych).
Endoskopowa skleroterapia iniekcyjna polega na dożylakowymi okołożylakowym wstrzyknięciu środka chemicznego za pomocą igły wprowadzonej przez kanał biopsyjny endoskopu. Najczęściej stosowanymi preparatami w tej terapii są polidokanol, oleśnian etanoloaminy, siarczan sodowy tetradecylu, alkohol absolutny, hipertoniczna glukoza oraz fenol. Nie wykazano przewagi w tamowaniu krwawień z żylaków przełyku żadnej z powyższych substancji nad pozostałymi. Mechanizm działania środków sklerotyzujących polega na aktywacji układu krzepnięcia, agregacji krwinek płytkowych, wywołaniu stanu zapalnego i w efekcie stymulacji procesu włóknienia. Kolejne zabiegi sklerotyzacji wykonuje się w odstępach 1‑3-tygodniowych (średnio 3‑6 sesji). Metoda ta pozwala na osiągnięcie hemostazy w 75‑93% przypadków. Jednakże u 35% chorych dochodzi do nawrotu krwawienia, a w 50% przypadków mogą wystąpić działania niepożądane (wczesne – ból zamostkowy, gorączka, dysfagia, wysięk opłucnowy oraz późne – owrzodzenia, zwężenia przełyku, perforacja, ostra niewydolność oddechowa, odma opłucnowa, zapalenie osierdzia, zapalenie śródpiersia, przetoki, porażenie rdzenia kręgowego, zakrzepica naczyń krezkowych, bakteriemia). Na uwagę zasługuje fakt, że efekty terapeutyczne skleroterapii i leczenia farmakologicznego są podobne przy uzyskaniu początkowej hemostazy, profilaktyki nawrotów krwawienia i śmiertelności. Udowodniono, że połączenie obu tych metod przynosi korzystniejsze rezultaty niż stosowanie ich osobno.
Inną skuteczną metodą iniekcyjną w leczeniu krwawień pochodzenia żylakowego są kleje tkankowe (cyjanoakryl, klej fibrynowy, trombina). Stosowane są szczególnie u chorych z krwotokami z żylaków zlokalizowanych w żołądku lub w przypadku masywnych krwawień z żylaków przełyku. Pozwalają one na zatamowanie krwawienia niemal w 100% przypadków. Działanie klejów cyjanoakrylowych polega na gwałtownej ich polimeryzacji po kontakcie z wodą, twardnieniu i zatrzymaniu krwawienia. Połączenie tej metody z iniekcją środków sklerotyzujących przyspiesza hemostazę i zwiększa przeżywalność chorych. Stosowanie klejów tkankowych może się jednak wiązać z działaniami niepożądanymi, takimi jak zator tętnicy płucnej, tętnic w jamie brzusznej, tętnic mózgowychczy zawał mięśnia sercowego.
Metodą z wyboru w endoskopowym leczeniu krwotoku z żylaków przełyku jest opaskowanie. Zabieg polega na zassaniu żylaka do plastikowej tulejki umieszczonej na końcu endoskopu, a następnie zsunięciu gumowej opaski na podstawę żylaka. W wyniku tego postępowania dochodzi do wytworzenia zakrzepu w świetle poszerzonego żylakowato naczynia, a następnie do rozwoju martwicy. Żylak odpada po 3‑5 dniach, pozostawiając owrzodzenie, które goi się po ok. 2 tygodniach. Podczas pierwszego zabiegu zakłada się 2‑6 opasek. Zabieg powtarza się co 1‑2 tygodnie aż do uzyskania sytuacji, w której żylaki są na tyle małe, że nie pozwalają na umieszczenie na nich opaski. Powikłania tej terapii są zwykle niegroźne i obejmują przejściową dysfagię lub niewielkie krwawienia z powierzchownych owrzodzeń pozostałych po odpadnięciu żylaków. Opaskowanie jest skuteczniejszą metodą niż skleroterapia, zmniejsza śmiertelność w krwawieniach z żylaków przełyku, a jej powikłania są łagodniejsze od tych spotykanych w metodach iniekcyjnych. Należy jednak szczególnie podkreślić, że najlepsze wyniki leczenia uzyskuje się przy połączeniu metod endoskopowych z farmakologicznymi.
W przypadku braku skuteczności leczenia farmakologicznego i endoskopowego stosuje się metody radiologii zabiegowej lub leczenie chirurgiczne. Leczenie radiologiczne polega na wytworzeniu wewnątrzwątrobowego zespolenia wrotno-żylnego przez umieszczenie protezy naczyniowej z dostępu przez żyłę szyjną wewnętrzną (ang. transjugularintrahepatic porto-systemicshunt, TIPS). Zabieg ten powoduje dekompresję w obrębie układu żyły wrotnej i umożliwia zahamowanie krwawienia. Leczenie chirurgiczne polega na wykonaniu zespoleń wrotno-systemowych redukujących ciśnienie w układzie żyły wrotnej lub na zabiegach na przełyku odbarczających przepływ krwi przez krążenie oboczne. Należy zaznaczyć, że spośród wyżej wymienionych metod zabiegowych rekomendowany jest zabieg TIPS, który przeprowadzony w ciągu 24 godzin od początku krwawienia przynosi zwiększenie przeżywalności.
Przez żylne śródwątrobowe zespolenie wrotno-systemowe jest skuteczną metodą kontroli aktywnego krwawienia z żylaków przełyku i zapobiegania jego nawrotom. Jego skuteczność sięga 90%, jednakże towarzyszą mu liczne powikłania, wśród których należy wymienić istotne nasilenie encefalopatii (10‑44% pacjentów), okluzję stentu (18‑78%), przebicie przez torebkę wątroby (33%), migrację stentu (20%), hemolizę (10‑15%) oraz sepsę i krwawienie do jamy otrzewnowej. Wskazaniem do stosowania TIPS jest głównie profilaktyka wtórna krwawienia z żylaków przełyku oraz oporne na leczenie wodobrzusze, a także niedające się opanować krwawienia z żylaków, gastropatia wrotna, krwawienie z żylaków żołądka, żołądek arbuzowaty, zespół wątrobowo-nerkowy, zespół wątrobowo-płucny, zespół Budda-Chiariego. Należy szczególnie podkreślić, że zastosowanie TIPS powinno być zarezerwowane dla pacjentów, u których pozostałe metody leczenia okazały się nieskuteczne. Wśród bezwzględnych przeciwwskazań do stosowania tej metody wymienia się pierwotną profilaktykę krwawień z żylaków przełyku, niewydolność zastoinową serca, mnogie torbiele wątroby, uogólnioną infekcję, nieodblokowaną obstrukcję dróg żółciowych, ciężkie nadciśnienie płucne. Jako względne przeciwwskazania do TIPS uznaje się guz wątroby, niedrożność żył wątrobowych, zakrzepicę żyły wrotnej, niewyrównaną koagulopatię, małopłytkowość <20 tys./mm3, umiarkowane nadciśnienie płucne oraz stężenie bilirubiny w surowicy >3,0 g/dl.
Wśród chirurgicznych metod leczenia krwawienia z żylaków przełyku wyróżnia się wytworzenie zespolenia wrotno-systemowego oraz tzw. operacje typu nonshunt. Najczęściej stosowanymi zespoleniami są zespolenie żyły wrotnej z żyłą główną koniec do boku, bok do boku oraz zespolenie żyły śledzionowej z żyłą nerkową centralne lub dystalne. Zabiegi non-shunt polegają natomiast na usuwaniu żylaków przełyku bez wytwarzania zespoleń wrotno-systemowych. Przykładem tej metody jest operacja Sugiury polegająca na rewaskularyzacji przełykowo-żołądkowej, transsekcji i splenektomii. Wykonuje się ją zwykle u osób z rozległą zakrzepicą żyły wrotnej, śledzionowej i krezkowej górnej, u których niemożliwe jest wytworzenie zespoleń wrotno-systemowych.
W przypadku braku możliwości przeprowadzenia pilnego zabiegu endoskopowego lub w oczekiwaniu na zabieg radiologiczny albo chirurgiczny stosuje się tamponadę balonem Sengstakena-Blakemore‘a. Sonda ta składa się z dwóch balonów – żołądkowego i przełykowego oraz zgłębnika umożliwiającego aspirację treści żołądkowej. Zgłębnik wprowadza się przez nos, a następnie napełnia oba balony powietrzem. Balon żołądkowy rozprężany jako pierwszy zapewnia stabilizację sondy w żołądku oraz tamponadę ewentualnych żylaków dna żołądka. Balon przełykowy powoduje zatrzymanie krwawienia z żylaków przełyku. Istotnym elementem tej procedury jest naciągnięcie sondy przez linkę z ciężarkiem o masie ok. 250‑500 mg. Dopuszcza się stosowanie sondy Sengstakena-Blakemore’a przez maksymalnie 24 godziny, gdyż jej dłuższe pozostawienie może wywołać martwicę błony śluzowej i głębokie owrzodzenia. Dodatkowo zaleca się opróżniać balon przełykowy co 4 godziny w celu sprawdzenia efektywności hemostazy. Metoda ta pozwala na zatrzymanie krwawienia z żylaków przełyku w 60‑90% przypadków, jednak u połowy pacjentów dochodzi do ponownego krwawienia po usunięciu sondy. Powikłania tego postępowania dotyczą ok. 15‑25% chorych i wiążą się najczęściej z aspiracją treści żołądkowej do płuc.
Alternatywą dla stosowania sondy Sengstakena-Blakemore’asą samorozprężalnestenty metalowe (ang. Selfexpanding metal stents, SEMS), które cechują się podobną skutecznością w tamowaniu krwawienia z żylaków przełyku i mniejszą ilością powikłań. Fakt ten wynika z wystandaryzowanej siły rozszerzania i stopnia nacisku stentów na ścianę przełyku oraz mniejszego ryzyka przesunięcia się ich w przełyku. Umożliwiają one także łatwiejsze odessanie treści z żołądka i przeprowadzenie badania endoskopowego.
Prawdopodobieństwo wystąpienia ponownego krwawienia z żylaków przełyku w ciągu 1‑2 lat wynosi 60%, ze śmiertelnością sięgającą 33%. Ryzyko to zmniejsza się jednak w wyniku stosowanej profilaktyki polegającej na leczeniu nieselektywnymi b-adrenolitykami (propranolol, nadolol, tymolol) oraz eradykacji żylaków metodą opaskowania. Zaleca się połączenie obu tych sposobów leczenia.
Nieselektywne β-adrenolityki zmniejszają przepływ w układzie żyły wrotnej, co wynika głównie ze zmniejszenia objętości wyrzutowej serca (poprzez blokadę receptora β1) oraz ze skurczu naczyń trzewnych (poprzez blokadę receptora β2). Ponadto redukują one napływ krwi do krążenia obocznego przełykowo-żołądkowego i redukują ciśnienie w żylakach przełyku. Wpływ propranololu na HVPG jest jednak umiarkowany i pozwala na jego redukcję o ok. 12‑16%. Wśród przeciwwskazań do stosowania nieselektywnych β-adrenolityków wymienia się przewlekłą obturacyjną chorobę płuc, wady zastawki aortalnej, bloki przedsionkowo- komorowe II i III stopnia, cukrzycę insulinozależną. Ponadto u 9‑33% pacjentów obserwuje się działania niepożądane pod postacią hipotensji, bradykardii, łatwego męczenia, encefalopatii czy obniżenia libido. Leki te należy przyjmować przewlekle, w maksymalnej tolerowanej dawce oraz nie wywołać obniżenia częstości akcji serca poniżej 55/min i ciśnienia skurczowego krwi poniżej 90 mm Hg.
W profilaktyce kolejnego krwawienia z żylaków przełyku, oprócz stosowania nieselektywnych b-adrenolityków, stosuje się opaskowanie żylaków przełyku, które przeprowadza się co 1‑2 tygodnie, aż do uzyskania całkowitej eradykacji żylaków. Kontrolne badanie endoskopowe wykonuje się po 1‑3 miesiącach, a kolejne po 6‑12 miesiącach. Jeśli stwierdzi się nawrót żylaków przeprowadza się ponowne opaskowanie.
Profilaktyka pierwszego krwawienia z żylaków przełyku wymaga endoskopowej oceny wielkości żylaków i ustalenia klinicznego stopnia zaawansowania niewydolności wątroby. Jeśli nie stwierdza się obecności żylaków i cech dekompensacji marskości wątroby, kolejne badanie endoskopowe może być przeprowadzone po 3 latach. W przypadku obecności małych żylaków bez „czerwonych znamion” sugerujących podwyższone ryzyko wystąpienia krwawienia, powtórne badanie przeprowadza się po 2 latach. Wystąpienie pierwszych objawów niewydolności wątroby wymaga przeprowadzenia kolejnej gastroskopii po ok. 1 roku. Obecność „czerwonych znamion” na żylakach i występowanie objawów niewydolności wątroby stopnia B lub C wg Childa-Pugha wymaga włączenia terapii nieselektywnymi β-adrenolitykami oraz rozważenia przeprowadzenia zabiegów opaskowania żylaków. Pacjenci z małymi żylakami otrzymujący nieselektywne b-adrenolityki nie wymagają nadzoru endoskopowego. Dane dotyczące leczenia krwawienia z żylaków żołądka nie są równie jednoznaczne, jak w przypadku terapii krwawienia z żylaków przełyku. Zmiany te stwierdza się u 5‑33% pacjentów z nadciśnieniem wrotnym, zaś krwawienie występuje u 25% chorych w ciągu 2 lat od rozpoznania. Wyróżnia się dwa rodzaje żylaków żołądka: żołądkowo-przełykowe, będące przedłużeniem żylaków przełyku, oraz izolowane zlokalizowane w sklepieniu żołądka lub niekiedy w trzonie lub antrum. Czynnikami ryzyka wystąpienia krwawienia są wielkość żylaków, stopień niewydolności wątroby oraz obecność „czerwonych znamion”. Leczenie krwawienia z żylaków żołądkowo-przełykowych jest takie samo, jak w przypadku krwawienia z żylaków przełyku. Postępowanie w przypadku krwawienia z izolowanych żylaków dna żołądka polega na ostrzykiwaniu ich klejem tkankowym lub fibrynowym. Leczenie farmakologiczne jest identyczne jak w przypadku krwawienia z żylaków przełyku. W przypadku nieskuteczności leczenia endoskopowego i farmakologicznego lub nawrotów krwawienia z żylaków żołądka należy rozważyć zastosowanie TIPS.
KRWAWIENIA Z DOLNEGO ODCINKA PRZEWODU POKARMOWEGO
Krwawieniem z dolnego odcinka przewodu pokarmowego określa się krwawienie, którego źródło zlokalizowane jest poniżej więzadła Treitza. Objawia się zazwyczaj obecnością świeżej krwi, krwi zmieszanej ze stolcem lub krwistej biegunki. Szacuje się, że częstość jego występowania waha się w granicach 20‑27 przypadków na 100 000 osób rocznie. Ponadto stanowią one 25‑33% wszystkich krwawień z przewodu pokarmowego, częściej występują u mężczyzn niż u kobiet, a zapadalność wzrasta z wiekiem. Śmiertelność spowodowana krwawieniami z dolnego odcinka przewodu pokarmowego wynosi poniżej 5% i jest niższa niż w przypadku krwawień z GOPP.
Ustalenie źródła krwawienia jest konieczne u wszystkich pacjentów i opiera się przede wszystkim na metodach endoskopowych oraz na angiografii lub metodach radioizotopowych. Chorzy, u których krwawienie ustąpiło samoczynnie, poddawani są kolonoskopii w trybie planowym, po standardowym przygotowaniu. W przypadku utrzymującego się krwawienia badanie endoskopowe przeprowadza się w trybie pilnym. Masywny krwotok uniemożliwiający przygotowanie pacjenta do badania jest wskazaniem do angiografii, która oprócz diagnostyki umożliwia przeprowadzenie działań terapeutycznych pod postacią embolizacji krwawiących naczyń za pomocą alkoholu poliwinylowego, spirali lub rzadziej wazopresyny. Czułość kolonoskopii w lokalizacji źródła krwawienia wynosi 74‑90%. Należy także zaznaczyć, że 9% krwawień z dolnego odcinka przewodu pokarmowego ma swoje źródło w jelicie cienkim, gdzie w diagnostyce wykorzystuje się enteroskopię lub endoskopię kapsułkową. Kolejną metodę diagnostyczną stanowią badania radioizotopowe z wykorzystaniem erytrocytów znakowanych technetem (99mTc). Umożliwiają one detekcję krwawienia o nasileniu przekraczającym 0,5 ml/min. Ich czułość sięga 88%, lecz precyzyjna lokalizacja źródła krwawienia nie jest możliwa i ogranicza się jedynie do określenia segmentu brzucha, z którego się wywodzi.
Najczęstszą przyczyną krwawień z dolnego odcinka przewodu pokarmowego są krwawienia z uchyłków jelita grubego. W dalszej kolejności wymienia się angiodysplazje (10‑40% przypadków krwawień), zmiany nowotworowe (2‑26%), powikłania po polipektomii (2‑5%), nieswoiste choroby zapalne jelit (2‑6%), zapalenia jelit związane z niedokrwieniem (3‑9%), infekcje jelitowe, zmiany poradiacyjne, uchyłek Meckela, wgłobienia oraz żylaki odbytu i stosowanie niesteroidowych leków przeciwzapalnych.
Krwawienie z uchyłków jelita grubego dotyczy 3% pacjentów z uchyłkowatością jelita. Jednakże ze względu na częste występowanie tej choroby w krajach rozwiniętych, stanowi główną przyczynę krwawień z dolnego odcinka przewodu pokarmowego. Pomimo częstszego występowania uchyłków w lewej połowie jelita grubego udowodniono na podstawie badań angiograficznych, że krwawienia w tej grupie chorych mają źródło w prawej połowie okrężnicy w 70% przypadków. Objawia się ono zwykle obecnością domieszki świeżej krwi w stolcu bez towarzyszących dolegliwości bólowych. Krwawienia te często ustępują samoistnie (75‑80%), jednakże u 65‑75% chorych może wystąpić nawrót krwawienia. W celu uzyskania hemostazy stosuje się omawiane wcześniej zabiegi endoskopowe i metody radiologii zabiegowej. W przypadku braku ich skuteczności zalecane jest leczenie operacyjne, które przy braku ustalenia lokalizacji źródła krwawienia może obejmować nawet subtotalną kolektomię.
Angiodysplazja jest częstą przyczyną krwawień z dolnego odcinka pokarmowego. Zapadalność wzrasta z wiekiem (65% przypadków odnotowuje się u osób powyżej 70. roku życia) i wiąże się z występowaniem zmian degeneracyjnych w ścianie przewodu pokarmowego. Jednakże angiodysplazje mogą być również zmianami wrodzonymi i powodować krwawienie w pozostałych grupach wiekowych. Często stwierdza się mnogie angiodysplazje, a ich średnica zazwyczaj nie przekracza 5 mm. Zlokalizowane są one głównie w kątnicy i w prawej połowie jelita grubego. Krwawienia mają charakter przewlekły i utajony w 54% przypadków, zaś masywne krwawienie może wystąpić u 46% chorych. Czułość kolonoskopii w rozpoznawaniu krwawień ze zmian angiodysplastycznych sięga 80‑90%. Badanie angiografii tomografii komputerowej uzyskuje 70% czułość diagnostyczną. Klasyczna angiografia zazwyczaj nie umożliwia zlokalizowania źródła krwawienia. Leczenie opiera się głównie na endoskopowych metodach koagulacji kontaktowej i bezkontaktowej lub niekiedy na embolizacji naczyń pod kontrolą radiologiczną. Nawroty krwawienia obserwuje się u 10‑30% chorych. Trudności w uzyskaniu hemostazy powyższymi metodami są wskazaniem do leczenia chirurgicznego.
Krwawienie z dolnego odcinka przewodu pokarmowego wywołane obecnością zmian nowotworowych objawiają się zwykle skąpym krwawieniem pod postacią domieszki krwi w stolcu lub jedynie dodatniego wyniku testu na obecność krwi utajonej w stolcu. Dotyczy ono głównie osób po 50. roku życia. Często obserwuje się współistniejące objawy, takie jak ból w podbrzuszu czy utrata masy ciała. Rozpoznanie stawiane jest na podstawie badania endoskopowego i histopatologicznego, zaś leczenie opiera się na metodach chirurgicznych. Guzy zlokalizowane w jelicie cienkim występują rzadko, a do ich diagnostyki wykorzystuje się metody endoskopowe – enteroskopię, endoskopię kapsułkową lub badania radiologiczne – enteroklizę tomografii komputerowej, kontrastowe zdjęcia przewodu pokarmowego. Krwawienie będące powikłaniem polipektomii jest przyczyną 2‑5% wszystkich krwawień z dolnego odcinka przewodu pokarmowego. Może ono wystąpić w okresie 0‑17 dni po zabiegu i wymagać przetoczenia krwi u 50% chorych. W leczeniu stosuje się metody endoskopowe, uzyskując skuteczną hemostazę w 95% przypadków.
Krwawienia z guzków krwawniczych mają zwykle niewielkie nasilenie, a większość pacjentów nie szuka pomocy lekarskiej. Niedokrwistość z niedoboru żelaza lub masywne krwawienia występują w tej chorobie rzadko. Dolegliwości zwykle nasilają się podczas defekacji i oprócz obecności śladów świeżej krwi niezmieszanej ze stolcem mogą mieć charakter bólowy. W rozpoznaniu wykorzystuje się przede wszystkim badanie fizykalne, jednakże wskazane jest pełne badanie endoskopowe jelita grubego w celu dokładniejszej oceny nasilenia zmian oraz wykluczenia innej przyczyny krwawienia. W leczeniu stosuje się kąpiele nasiadowe, środki przeczyszczające oraz maści i czopki o działaniu przeciwzapalnym, przeciwobrzękowym, przeciwbólowym lub przeciwświądowym oraz zapobiegającym uszkadzaniu śródbłonka naczyń krwionośnych. W wypadku nawracających krwawień lub obecności dolegliwości bólowych zaleca się zabiegi chirurgiczne polegające głównie na opaskowaniu żylaków.
Krwawienia u chorych z nieswoistymi chorobami zapalnymi jelit mają zwykle umiarkowane nasilenie. Stwierdza się je częściej wśród pacjentów z chorobą Leśniowskiego-Crohna (ChLC) niż u osób chorych na wrzodziejące zapalenie jelita grubego (WZJG). Masywne krwawienie z dolnego odcinka przewodu pokarmowego jest powodem 1% wszystkich hospitalizacji pacjentów z ChLC. Leczenie chirurgiczne jest niezbędne w 20‑35% przypadków.
Infekcyjne zapalenia jelit wywołane przez Campylobacterjejuni, Salmonella sp., Shigella sp., Clostridium difficile lub inwazyjne szczepy Escherichia coli zwykle wywołują krwawienia o niewielkim nasileniu z towarzyszącą biegunką. W rozpoznaniu wykorzystuje się głównie posiewy stolca oraz badania endoskopowe. Terapia polega na celowanym leczeniu stwierdzonego patogenu.
Zmiany niedokrwienne jelit są zwykle stwierdzane u osób starszych. Mogą one dotyczyć wszystkich części dolnego odcinka przewodu pokarmowego, jednak najczęściej występują w okolicy zagięcia śledzionowego jelita grubego, okrężnicy zstępującej oraz esicy.Objawiają się bólem w lewym dole biodrowym z następującym w ciągu 24 godzin krwawieniem świeżą krwią lub krwistą biegunką. W rozpoznaniu można wykorzystać badanie endoskopowe i histopatologiczne. Krwawienia o niewielkim nasileniu mogą ustąpić samoistnie, jednakże w przypadku masywnego krwotoku lub objawów martwicy jelit niezbędne jest leczenie chirurgiczne.
Uchyłek Meckela jest jedną z najczęstszych anomalii rozwojowych przewodu pokarmowego. W badaniach autopsyjnych stwierdza się jego obecność w 0,3‑3,0%. W 50% przypadków w uchyłku Meckela stwierdza się błonę śluzową żołądka, dwunastnicy, jelita grubego lub fragmenty ektopowego utkania trzustkowego. Śluzówka żołądka o silnych właściwościach sekrecyjnych może przyczyniać się do powstawania owrzodzeń sąsiadującej błony śluzowej jelita. Obecność uchyłka Meckela w większości przypadków nie wywołuje żadnych objawów i nie wymaga terapii. Najczęstszym powikłaniem tej anomalii są krwawienia, które występują zwykle u dzieci. W rozpoznaniu wykorzystuje się metody radioizotopowe, enteroklizę lub angiografię. Leczenie operacyjne w przypadku obecności krwawienia jest postępowaniem z wyboru.
Wgłobienia jelit rozpoznawane są głównie u dzieci. W przypadku stwierdzenia ich u dorosłych należy podejrzewać obecność dodatkowej patologii, która mogłaby być ich przyczyną (najczęściej guzy nowotworowe lub zapalne). Objawiają się one krwawieniem ciemną krwią z towarzyszącymi silnymi bólami brzucha. W badaniu fizykalnym można niejednokrotnie stwierdzić obecność masy patologicznej. Rozpoznanie opiera się na badaniu przeglądowym jamy brzusznej, wlewie kontrastowym lub badaniu endoskopowym. Wykonanie wlewu doodbytniczego u dzieci pozwala zwykle na odprowadzenie wgłobienia. Leczeniem z wyboru u osób dorosłych jest przeprowadzenie zabiegu operacyjnego.
UTAJONE KRWAWIENIA Z PRZEWODU POKARMOWEGO
Utajone krwawienia z przewodu pokarmowego stanowią istotny problem kliniczny, który dotyczy znacznej grupy chorych. Objaw ten może być wynikiem wielu chorób górnego i dolnego odcinka przewodu pokarmowego. Istnieją trudności w epidemiologicznej ocenie tego zjawiska, ze względu na jego złożony charakter, trudności diagnostyczne, a także kłopoty z właściwym zdefiniowaniem. Sformułowanie definicji utajonego krwawienia z przewodu pokarmowego stwarza wiele trudności. Objawy mogą mieć charakter subkliniczny i być wykrywane przypadkowo, mogą również występować pod postacią jawnego krwawienia o niezidentyfikowanej lokalizacji. Amerykańskie Towarzystwo Gastroenterologiczne (American GastroenterologicalAssociation, AGA) proponuje podział na krwawienia utajone (occult) oraz krwawienia o nieokreślonej lokalizacji (obscure) o charakterze przewlekłym.
Krwawienia utajone rozpoznaje się na podstawie dodatniego testu na krew utajoną w kale lub/i w wyniku obecności niedokrwistości syderopenicznej. Nie stwierdza się wówczas cech jawnego krwawienia z przewodu pokarmowego (smolisty stolec, obecność krwi w stolcu, fusowate wymioty lub wymioty zmieszane z krwią). Krwawienia utajone wykrywane są często przypadkowo w trakcie podstawowej diagnostyki laboratoryjnej.
Krwawienia o nieokreślonej lokalizacji są zwykle jawne, lecz ich źródło pozostaje nieznane, mimo przeprowadzenia podstawowej diagnostyki endoskopowej (gastroskopia, kolonoskopia). Niekiedy mogą również występować pod postacią nawracającej i niepoddającej się leczeniu anemii syderopenicznej. Krwawienia utajone mogą ulec nasileniu i spełniać kryteria krwawień jawnych o nieokreślonej lokalizacji.
W diagnostyce krwawienia utajonego podstawowe badania endoskopowe wykrywają źródło krwawienia u około 50% chorych. Częściej stwierdza się zmiany w górnym odcinku przewodu pokarmowego (29‑36%) niż w jelicie grubym (22‑26%). Należą do nich: choroba wrzodowa (9‑19%), zapalenie przełyku (8‑18%), rak jelita grubego (6‑11%), angiodysplazja (2‑8%). Szczególnej uwagi wymaga częstość rozpoznawania gruczolaków jelita grubego. Stwierdza się je częściej u chorych z dodatnim wynikiem testu na krew utajoną (12‑14%) niż u chorych kwalifikowanych do diagnostyki endoskopowej z powodu obecności anemii syderopenicznej(5‑10%). Częstość wykrywania pozostałych źródełkrwawienia z przewodu pokarmowego nie jest zależna od wskazań do diagnostyki. Zauważono, że niedokrwistość syderopeniczna jest objawem występującym później niż obecność krwi utajonej w kale i ujawnia się przy zmianach bardziej nasilonych lub długotrwałych. Do pozostałych przyczyn utajonego krwawienia z przewodu pokarmowego należą m.in. zmiany zapalne o różnej etiologii, anomalie naczyniowe, niektóre choroby zakaźne i pasożytnicze, rzadziej występujące nowotwory, a także krwawienia spoza przewodu pokarmowego.
Chorzy z krwawieniem z przewodu pokarmowego o nieustalonej lokalizacji przebyli już zwykle podstawowe badania endoskopowe (gastroskopia, kolonoskopia), które nie pozwoliły na ustalenie źródła krwawienia. Dalsza diagnostyka obejmuje enteroskopię i endoskopię kapsułkową. Najczęstszą przyczynę krwawień o utajonej lokalizacji stanowią zmiany naczyniowe (8‑45%) i guzy jelita cienkiego (0‑17%). Przy użyciu śródoperacyjnej enteroskopii będącej metodą o dużym ryzyku powikłań i stosowanej wyłącznie ze wskazań życiowych przy nieskuteczności innych metod diagnostycznych identyfikuje się zmiany naczyniowe w 34%,wrzody jelita cienkiego w 27%, nowotwory w 2%. Należy podkreślić, że dużą grupę pacjentów (28‑75%) stanowią osoby, u których jednak w wyniku kolejnych badań stwierdza się źródło krwawienia o lokalizacji dostępnej panendoskopii i kolonoskopii, najczęściej chorobę wrzodową (11%), ubytki błony śluzowej w obrębie wpustu u chorych z przepukliną rozworu przełykowego – wrzód Camerona (8%), a także zapalenie przełyku, polipy żołądka, zmiany naczyniowe żołądka i dwunastnicy.
Wśród omawianych chorych dużą grupę stanowią osoby przyjmujące przewlekle niesteroidowe leki przeciwzapalne (u 56% z nich wykazano wrzody w jelicie cienkim przy użyciu enteroskopii). Przyczyny krwawienia zmieniają się w zależności od wieku chorych. Zmiany naczyniowe diagnozuje się u 40% pacjentów powyżej65. roku życia, podczas gdy ten odsetek u osób młodszychwynosi 12%. Przeciwną tendencję obserwuje sięw zakresie częstości zachorowań na guzy jelita cienkiego.Zmiany te diagnozowano u 14% badanych poniżej 50. roku życia, zaś u osób starszych – w 3%.
Warto również nadmienić, że krwawienia uznane początkowo za pochodzące z przewodu pokarmowego mogą mieć inne źródło, np. drogi oddechowe, gardło, jama ustna i nosowa.
Bardzo istotnym elementem leczenia omawianych krwawień jest suplementacja niedoborów żelaza i/lub wyrównanie zaburzeń krzepnięcia. U chorych z niewielką utratą krwi może być to działanie wystarczające i poprawiające stan chorego będącego w trakcie diagnostyki. Warto zaznaczyć, że jednoczesne podawanie kwasu askorbinowego zwiększa wchłanianie żelaza. Zawartość żelaza w standardowej diecie jest niewystarczająca do odbudowania zapasów tego pierwiastka. Stałe przyjmowanie preparatów żelaza w dawce 325 mg/dobę, bez obecności jednoczesnego krwawienia, powoduje normalizację poziomów hemoglobiny po około 2 miesiącach, zaś uzupełnienie zapasów żelaza – po 3‑6 miesiącach. W ocenie tej gospodarki pomocne jest oznaczenie poziomu ferrytyny i całkowitej zdolności wiązania żelaza. Preparaty żelaza należy przyjmować na czczo i jednocześnie ograniczyć spożycie produktów mlecznych, mąki i kaszy, które zmniejszają ich wchłanianie. Do obserwowanych działań niepożądanych terapii żelazem należą zaparcia, biegunki, zgaga i nudności. Ustępują one po redukcji dawki. Należy przerwać podawanie preparatów żelaza u pacjentów z wyrównaną gospodarką tego pierwiastka. Należy podkreślić, że doustna podaż żelaza jest równie skuteczna co suplementacja pozajelitowa, którą powinno się stosować jedynie u chorych z zaburzeniami wchłaniania, źle tolerujących formy doustne, niewspółpracujących lub u dializowanych leczonych erytropoetyną. Parenteralne formy żelaza mogą w rzadkich przypadkach wywołać niebezpieczne działania niepożądane pod postacią odczynów nadwrażliwościlub zakrzepicy żylnej w przypadku podania preparatu do naczyń. Obfita utrata krwi z nasilonymi cechami klinicznymi anemizacji wymaga zwykle przetoczenia koncentratu krwinek czerwonych i świeżo mrożonego osocza. Wybór ukierunkowanej terapii zależy od przyczyny krwawienia. Wykorzystuje się metody endoskopowe, naczyniowe, farmakologiczne oraz chirurgiczne omawiane powyżej. Utajone krwawienia nie są związane z wysokimi wskaźnikami umieralności. Chorzy są diagnozowani zwykle w sposób planowy, co zwiększa prawdopodobieństwo ustalenia właściwego rozpoznania. Na podstawie analiz wielu doniesień należy wnioskować, że nie ma prostej i uniwersalnej metody postępowania z omawianymi chorymi. Zazwyczaj wymagane jest przeprowadzanie licznych, bardzo szczegółowych badań przewodu pokarmowego. Niekiedy jednak powinno się rozważyć rzeczywistą konieczność przeprowadzenia dalszych działań diagnostycznych, oszacować bilans korzyści – ryzyka i ewentualnie zastosować terapię empiryczną celem zredukowania krwawienia oraz poprawy jakości życia chorych.
Żródło:Society of Gastroenterology Endoscopy Committee: Non-variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002; Adler D.G., Leighton J.A., Davila R.E. i wsp.; ASGE: ASGE guideline: the role of endoscopy in acute nonvaricealupper-GI hemorrhage. Gastrointest. Endosc. 2004; Marek T., Baniukiewicz A., Wallner G., Rydzewska G., Dąbrowski A.: Wytyczne postępowania w krwawieniu z górnego odcinka przewodu pokarmowego pochodzenia nieżylakowego. PrzeglądGatroenterologiczny 2008; Rockall T.A., Logan R.F., Devlin H.B., Northfield T.C.: Risk assessment after acute upper gastrointestinal haemorrhage.Gut 1996; Frossard J.L., Spahr L., Queneau P.E. i wsp.: Erythromycin intravenous bolus infusion in acute upper gastrointestinal bleeding: a randomized, controlled, double blind trial. Gastroenterology 2002;Forrest J.A., Finlayson N.D., Shearman D.J.: Endoscopy in gastrointestinal bleeding. Lancet 1974; 2: Wu J.C., Sung J.J.: Upper gastrointestinal bleeding diseases. W: Classen M., Tytgat G.N., Lightdale C.J. (red.): Gastroenterological Endoscopy. Thieme, Stuttgart 2002:Chung S.C., Leung J.W., Steele R.J. i wsp.: Endoscopic injection of adrenaline for actively bleeding ulcers: a randomized trial. Br. Med. J. (Clin. Res. Ed.) 1988; Havanond C., Havanond P.: Argon plasma coagulation therapy for acute non-variceal upper gastrointestinal bleeding. Cochrane Database Syst. Rev. 2005;Sung J.J., Tsoi K.K., Lai L.H. i wsp.: Endoscopic clipping versus injection and thermo-coagulation in the treatment of non-variceal upper gastrointestinal bleeding: a meta-analysis. Gut 2007; Leontiadis G.I., Howden C.W.: Pharmacologic treatment of peptic ulcer bleeding. Curr. Treat. Options Gastroenterol. 2007;Imperiale T.F., Birgisson S.: Somatostatin or octreotidecompared with H2 antagonists and placebo in the management of acute nonvariceal upper gastrointestinal hemorrhage: a meta-analysis. Ann. Intern. Med. 1997; Lau J.Y., Sung J.J., Lam Y.H. i wsp.: Endoscopic retreatment compared with surgery in patients with recurrent bleeding after initial endoscopic control of bleeding ulcers. N. Engl. J. Med. 1999; 340: Vakil N., Fennerty M.B.: Direct comparative trials of the efficacy of proton pump inhibitors in the management of gastro-oesophageal reflux disease and peptic ulcer disease. Aliment. Pharmacol. Ther. 2003;Ramakrishnan K., Salinas R.C.: Peptic ulcer disease. Am. Fam. Physician 2007; Pagliaro L., D’Amico G., Pasta L. i wsp.: Portal hypertension in cirrhosis: natural history. W: Bosch J., GroszmannR.J. (red.): Portal Hypertension. Pathophysiology and Treatment. Blackwell Scientific, Oxford 1994:Chalasani N., Kahi C., Francois F. i wsp.: Improved patient survival after acute variceal bleeding: a multicenter, cohort study. Am. J. Gastroenterol. 2003;Wróblewski E., Dąbrowski A.: Zasady leczenia krwawień z żylaków przełyku. PrzeglądGastroenterologiczny 2010; Garcia-Tsao G., Sanyal A.J., Grace N.D., Carey W.D.: Prevention and managament of gastroesophagealvaricesand variceal hemorrhage in cirrhosis. Am. J. Gastroenterol.2007; Moitinho E., PlanasR., Bañares R. i wsp.; VaricealBleeding Study Group: Multicenter randomized controlled trial comparing different schedules of somatostatinin the treatment of acutevariceal bleeding. J. Hepatol. 2001; Romero-Castro R., Jimenez-Saenz M., Pellicer-Bautista F. i wsp.: Recombinant-activated factor VII as hemostatic therapy in eight cases of severe hemorrhage from esophageal varices. Clin. Gastroenterol. Hepatol. 2004;Bernard B., Grangé J.D., Khac E.N. i wsp.: Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a metaanalysis. Hepatology 1999;Hou M.C., Lin H.C., Liu T.T. i wsp.: Antibiotic prophylaxis after endoscopic therapy prevents rebleeding in acute variceal hemorrhage: a randomized trial. Hepatology2004; Zuberi B.F., Baloch Q.: Comparison of endoscopic varicealsclerotherapy alone and in combination with octreotidein controlling acute variceal hemorrhage and earlyrebleeding in patients with low risk cirrhosis. Am. J. Gastroenterol. 2000; 95: 768-771. Huang Y.H., Yeh H.Z., Chen G.H. 25. i wsp.: Endoscopic treatment of bleeding gastric varices by N-butyl-2-cyanoacrylate (Histoacryl) injection: long-term efficacy and safety. Gastrointest. Endosc. 2000;Abraldes J.G., Bosh J.: The treatment of acute varicealbleeding. J. Clin. Gastroenterol. 2007;Rösch J., Keller F.S.: Transjugular intrahepatic portosystemicshunt: present status, comparison with endoscopic therapy and shunt surgery, and future prospectives. World J. Surg. 2001; Chen H., Sola J.E., Lillemoe K.D.: Najczęstsze zabiegi chirurgiczne przy łóżku chorego. Wydanie polskie pod redakcją A. Staniszewskiego. Bosch J., García-Pagán J.C.: Prevention of varicealrebleeding. Lancet 2003;Elta G.H.: Approach to the patient with gross gastrointestinal bleeding. W: Yamada T., Alper D.H. (red.): Textbook of Gastroenterology. Wyd. 4. Philadelphia 2003: Zuckerman G.R., Prakash C.: Acute lower intestinal bleeding. Part I: Clinical presentation and diagnosis. Gastrointest. Endosc. 1998;Ng D.A., Opelka F.G., Beck D.E. i wsp.: Predictive value of technetium Tc 99m-labeled red blood cell scintigraphyfor positive angiogram in massive lower gastrointestinal hemorrhage. Dis. Colon Rectum 1997; McGuire H.H. Jr: Bleeding colonic diverticula. A reappraisal of natural history and management. Ann. Surg. 1994; Santos J.C.M., ApilliF., Guimaräes A.S., Rocha J.J.: Angiodysplasia of the colon: endoscopic diagnosis and treatment. Br. J. Surg. 1988; Peura D.A., Lanza F.L., Gostout C.J., Foutch P.G.: TheAmerican College of Gastroenterology Bleeding Registry: preliminary findings. Am. J. Gastroenterol. 1997; Belaiche J., Lousi E.,D’Haens G. i wsp.: Acute lower gastrointestinal bleeding in Crohn’s disease: characteristics of a unique series of 34 patients. Am. J. Gastroenterol. 1999;Zuckerman G.R., Prakash C., Askin M.P., Lewis B.S.: AGA technical review on the evaluation and management of occult and obscure gastrointestinal bleeding. Gastroenterology 2000; Ahlquist D.A.: Approach to the patient with occult gastrointestinal bleeding. W: Yamada T., Alper D.H. (red.): Textbook of Gastroenterology. Wyd. 4. PhiladelphiaMitchell S.H., Schaefer D.C., Dubagunta S.: A new view of occult and obscure gastrointestinal bleeding. Am. Fam. Physician 2004;
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny












Więcej
Czy ludzie agresywni powinni być izolowani i co się dzieje z ich mózgiem?
Czy Polsce grozi epidemia Ćpunów?
Ci ludzie są tak głupi a może tak mądrzy albo chorzy?