
Ostatnia aktualizacja 28 lipca 2022
Ból fizyczny jest jednym z najczęstszych objawów somatycznych u pacjentów cierpiących na depresję i odwrotnie, pacjenci cierpiący na przewlekły ból różnego pochodzenia często mają depresję. Istotnie, objawy bólu fizycznego u pacjentów z depresją wiążą się z poważniejszym rokowaniem, dłuższym czasem trwania choroby, większym upośledzeniem funkcjonowania, gorszym wynikiem klinicznym i zwiększonymi kosztami opieki zdrowotnej. Co więcej, nasilenie bólu jest skorelowane z nasileniem objawów depresji. Chociaż dane te silnie sugerują, że depresja jest powiązana ze zmienioną percepcją bólu, do tej pory w dziedzinie badań psychiatrycznych leczeniu bólu poświęcono niewiele uwagi (Elman i in., 2011).
Układ monoaminergiczny wpływa zarówno na nastrój, jak i na odczuwanie bólu (Delgado, 2004), a ponieważ wiele leków przeciwdepresyjnych modyfikuje właściwości monoamin, związki te mogą być skuteczne w leczeniu bólu przewlekłego różnego pochodzenia u pacjentów bez depresji oraz w łagodzeniu bólu u pacjentów z depresją. Istnieje wiele dowodów potwierdzających przeciwbólowe właściwości trójpierścieniowych leków przeciwdepresyjnych (TCA), szczególnie amitryptyliny, a inny TCA, duloksetyna, został zatwierdzony jako lek przeciwbólowy w bólu w neuropatii cukrzycowej. Natomiast dane dotyczące właściwości przeciwbólowych selektywnych inhibitorów wychwytu zwrotnego serotoniny (SSRI) są ograniczone (Saarto i Wiffen, 2007). Ogólnie rzecz biorąc, związki o noradrenergicznym i serotoninergicznym sposobie działania są bardziej skutecznymi analgetykami (Saarto & Wiffen, 2005), chociaż podstawowe mechanizmy działania pozostają słabo poznane, leki przeciwdepresyjne wydają się wzmacniać endogenną analgezję i uważa się, że zwiększają one aktywność zstępującej hamującej drogi opuszkowo-rdzeniowej, która jest upośledzona w bólu przewlekłym (Mico et al., 2006a).
Chociaż przydatność wielu leków przeciwdepresyjnych w leczeniu bólu jest dobrze poznana, pozostaje niejasne, czy leki przeciwdepresyjne łagodzą ból poprzez działanie na nastrój (ból emocjonalny), czy na przekaźnictwo nocyceptywne (ból czuciowy). W wielu przypadkach nie ma bowiem korelacji pomiędzy poziomem bólu odczuwanego przez pacjenta a wpływem leków przeciwdepresyjnych na nastrój. Dlatego też w tym rozdziale podsumujemy naszą aktualną wiedzę dotyczącą stosowania leków przeciwdepresyjnych w leczeniu bólu przewlekłego oraz w leczeniu bólu jako somatycznego objawu depresji. Omówione zostaną mechanizmy farmakologiczne i podłoża neurobiologiczne leżące u podstaw właściwości przeciwbólowych leków przeciwdepresyjnych, a także zróżnicowane działanie przeciwbólowe poszczególnych rodzajów leków przeciwdepresyjnych.
Depresja i ból to choroby powiązane
Depresja i ból to dwa wzajemnie powiązane i bardzo rozpowszechnione schorzenia. Badania epidemiologiczne przeprowadzone w klinikach leczenia bólu wskazują, że częstość występowania dużych zaburzeń depresyjnych wynosi 52% i waha się od 1,5-100% w zależności od rodzaju bólu przewlekłego, a częstość występowania bólu u pacjentów z depresją waha się od 15-100% (Bair i wsp., 2003). Depresja jest definiowana jako zaburzenie afektywne, które charakteryzuje się złym nastrojem, poczuciem bezwartościowości, zmniejszeniem zainteresowania przyjemnymi bodźcami oraz upośledzeniem zdolności podejmowania decyzji. Ponadto, depresja ma wymiar somatyczny, który charakteryzuje się zmianą masy ciała, zmęczeniem, zaburzeniami snu, bólami głowy, brzucha i innymi objawami bólowymi (DSM-IVR, 2000), takimi jak bóle pleców, karku i ramion oraz bóle mięśniowo-szkieletowe (Leino i Magni, 1993). Pacjenci z depresją mogą również doświadczać zwiększonej reakcji na ból lub związane z nim cierpienie, a w warunkach podstawowej opieki zdrowotnej często skarżą się na specyficzne rodzaje bólu, w tym ból brzucha, stawów, klatki piersiowej i głowy (Kroenke i in., 1994; Mathew i in., 1981). Istotnie, ból dolnej części pleców jest dwukrotnie częściej zgłaszany przez pacjentów z depresją niż przez pacjentów bez depresji (Croft i in., 1995).
Według IASP (International Association for Study of Pain), ból jest definiowany jako “nieprzyjemne doświadczenie zmysłowe i emocjonalne związane z rzeczywistym lub potencjalnym uszkodzeniem tkanek, lub opisywane w kategoriach takiego uszkodzenia” (Merskey, 1994). Na odczuwanie bólu mogą mieć również istotny wpływ czynniki emocjonalne i psychospołeczne. Odpowiednio, depresja może nasilać reakcję na bodźce bólowe (Berna et al., 2010).
Dowody na przeciwbólowe działanie leków przeciwdepresyjnych
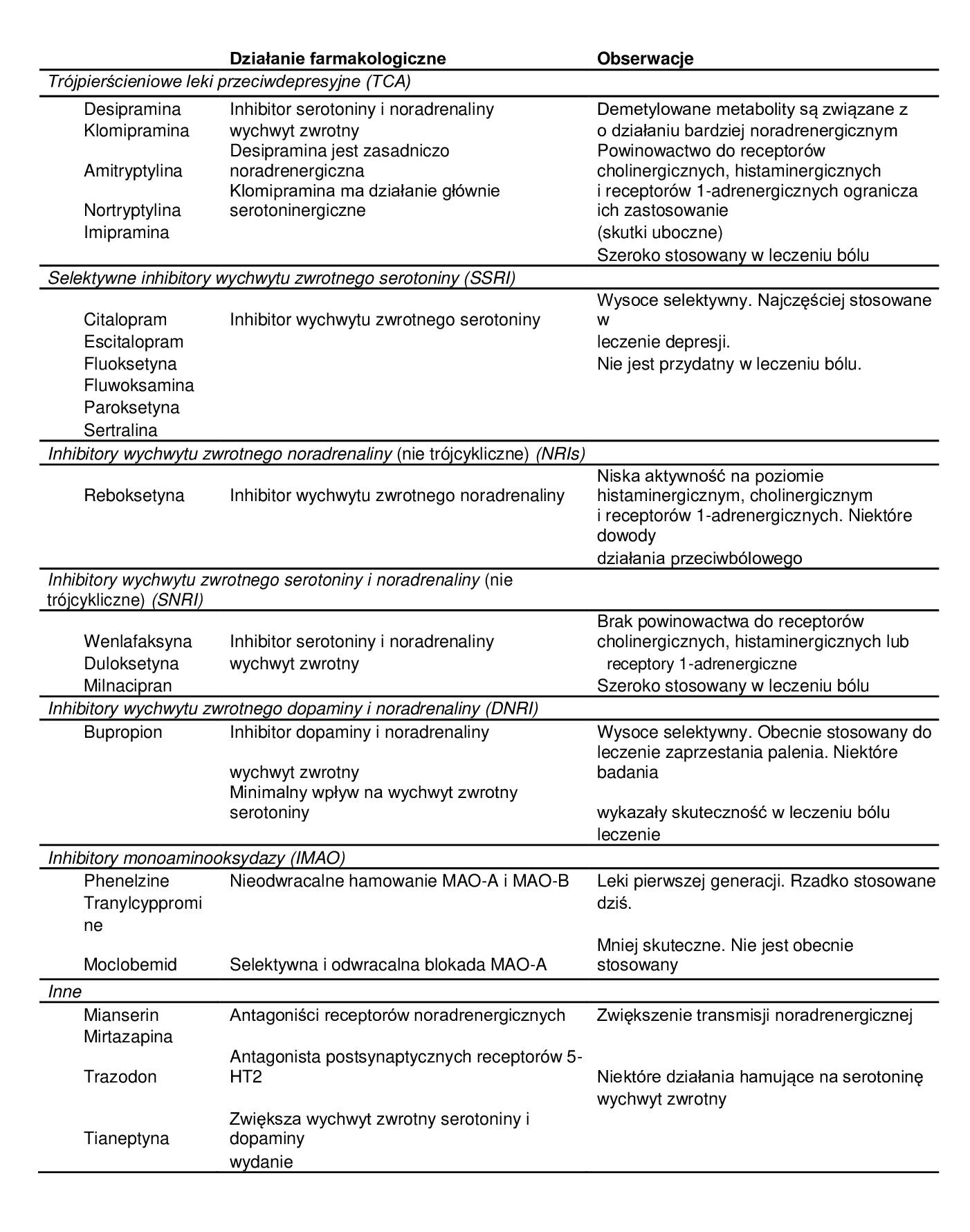
Obecnie leki zwiększające stężenie monoamin poprzez hamowanie wychwytu zwrotnego neuroprzekaźników stanowią pierwszą linię leczenia depresji, stanowiąc niejednorodną farmakologicznie grupę określaną ogólnym mianem “leków przeciwdepresyjnych”. Typowe leki przeciwdepresyjne klasyfikowane są według mechanizmu działania (patrz tab. 1) i należą do nich klasyczne TCA, SSRI, inhibitory wychwytu zwrotnego noradrenaliny (NRI) oraz mieszane leki przeciwdepresyjne niebędące TCA (SNRI – inhibitory wychwytu zwrotnego serotoniny i noradrenaliny). Do tej grupy należą również inhibitory wychwytu zwrotnego dopaminy i noradrenaliny (DNRI) oraz odwracalne inhibitory monoaminooksydazy (MAOI), które hamują zarówno podtyp A, jak i B enzymu monoaminooksydazy (MAO-A i MAO-B). Działanie atypowych leków przeciwdepresyjnych polega lub polega wyłącznie na blokowaniu receptorów 2-adrenergicznych i/lub receptorów 5-HT2A.
Badania kliniczne
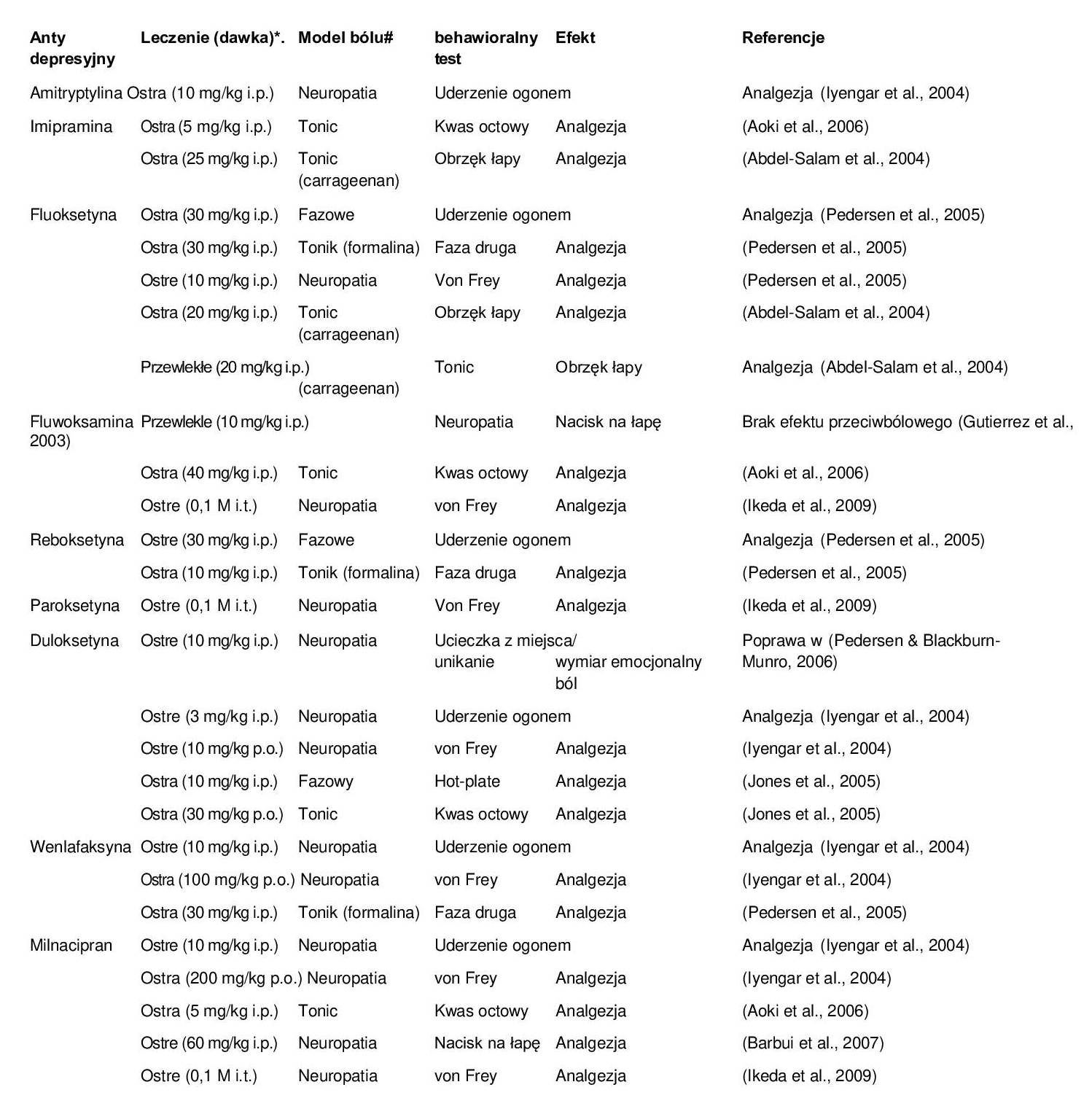
W kilku badaniach wykazano wewnętrzne działanie przeciwbólowe leków przeciwdepresyjnych (McQuay et al., 1996; Onghena & Van Houdenhove, 1992; Smith et al., 1998). Nadal jednak nie jest jasne, czy leki przeciwdepresyjne są skuteczne w leczeniu wszystkich rodzajów bólu, czy tylko jego specyficznych podtypów. Ból jest zaburzeniem heterogennym, które może mieć różne źródła: 1) ból nocyceptywny: wywołany zmianą chorobową lub potencjalnym uszkodzeniem tkanek; 2) zapalny: występujący jako konsekwencja procesu zapalnego, 3) ból neuropatyczny: wywołany uszkodzeniem układu nerwowego i wreszcie 4) ból, którego źródłem nie jest zaburzenie neurologiczne ani nieprawidłowość tkanek obwodowych (zespół jelita drażliwego, fibromialgia i napięciowy ból głowy). Dostępne obecnie dowody sugerują, że antynocyceptywne działanie leków przeciwdepresyjnych jest szczególnie istotne w leczeniu bólu przewlekłego, zwłaszcza neuropatycznego. Dlatego też leki przeciwdepresyjne stanowią pierwszą linię leczenia farmakologicznego tej choroby, wraz z lekami przeciwdrgawkowymi, takimi jak gabapentyna i pregabalina (Baidya i wsp., 2011; Moore i wsp., 2011). Ból neuropatyczny jest stanem przewlekłego bólu spowodowanego uszkodzeniem układu nerwowego. Obecnie TCA (amitryptylina, nortryptylina, imipramina i klomipramina) są najczęściej stosowanymi lekami przeciwdepresyjnymi w leczeniu neuropatycznych procesów bólowych związanych z cukrzycą, chorobami nowotworowymi, infekcjami wirusowymi i uciskiem nerwów. Wśród TCA amitryptylina jest uważana za “złoty standard” (Fishbain, 2003), z wykazanym efektem przeciwbólowym w kilku stanach bólowych, w tym bólach głowy i fibromialgii (Arnold i in., 2000; Descombes i in., 2001; Reisner, 2003). W innych badaniach klinicznych wykazano również skuteczność wenlafaksyny w kilku schorzeniach, takich jak migrena, fibromialgia i ból neuropatyczny, a także ból nowotworowy (Dwight i wsp., 1998; Tasmuth i wsp., 1998; Taylor i Rowbotham, 1996). Mimo że wenlafaksyna należy do SNRI, w niższych dawkach działa przede wszystkim na przekaźnictwo serotoninergiczne i nie wykazuje powinowactwa do receptorów cholinergicznych i histaminergicznych, co daje przewagę nad TCA pod względem niepożądanych działań ubocznych. Po ostatnich pozytywnych wynikach kontrolowanych badań klinicznych, duloksetyna została również zaproponowana jako odpowiedni lek w leczeniu neuropatii cukrzycowej (Goldstein i in., 2005; Leo & Barkin, 2003), a inny SNRI o działaniu przeciwbólowym, milnacipran, okazał się skuteczny w leczeniu fibromialgii (Leo & Brooks, 2006). SSRI zostały z powodzeniem wprowadzone w latach 80. jako skuteczne leki w leczeniu depresji, jednak w odniesieniu do bólu przewlekłego związki te okazały się nie bardziej skuteczne niż tradycyjne TCA (McMahon, 2006). Co więcej, niektórzy autorzy sugerują, że SSRI mogą wzmacniać proces leżący u podstaw bólu ostrego (Dirksen R, 1998). W metaanalizie analgezji wywołanej przez leki przeciwdepresyjne przeprowadzonej przez Onghenę i współpracowników stwierdzono, że selektywne NRI nie były bardziej skuteczne niż leki przeciwdepresyjne o podwójnym działaniu (Onghena & Van Houdenhove, 1992). Jednak na podstawie opisanych tu dowodów można stwierdzić, że leki hamujące wychwyt zwrotny monoamin mogą być skuteczne w leczeniu bólu przewlekłego. Wiadomo, że w bólu przewlekłym występuje zwiększona częstotliwość odpalania potencjałów czynnościowych w nocyceptorach (Emery i in., 2011), które aktywują wiele mechanizmów patofizjologicznych prowadzących do różnych grup objawów (ból spontaniczny, hiperalgezja, allodynia…) w każdym stanie bólowym. Dotychczasowe dowody ograniczają się do powiązania rodzajów bólu z kategoriami leków; na przykład, niesteroidowe leki przeciwzapalne (NSAIDS) z bólem zapalnym lub leki przeciwdepresyjne i przeciwdrgawkowe z bólem neuropatycznym. Rozróżnienie różnych rodzajów objawów pozostaje jednak istotne dla oceny i leczenia bólu w oparciu o mechanizm. Utrudnia to identyfikację korelacji różnych objawów bólowych z różnymi układami neuroprzekaźnikowymi (noradrenergicznym, sertonergicznym, opioidowym…).
Oprócz zastosowania w leczeniu bólu przewlekłego, leki przeciwdepresyjne łagodzą również objawy fizyczne (ból) związane z depresją. To działanie przeciwbólowe jest typowe dla leków przeciwdepresyjnych, które zwiększają stężenie noradrenaliny i serotoniny. Ogólnie rzecz biorąc, TCA wykazały skuteczność przeciwbólową w różnych stanach bólowych (np. ból pleców, fibromialgia i migrena) u pacjentów z depresją (Barbui i in., 2007; Hansen i in., 2005; McDermott i in., 2006; Mico i in., 2006b). W badaniach klinicznych wenlafaksyna z grupy SNRI była skuteczniejsza w leczeniu fizycznych objawów depresji niż leki z grupy SSRI, co sugeruje, że emocjonalne i fizyczne objawy depresji są modulowane przez różne mechanizmy (Nemeroff CN, 2003; Thase i wsp., 2001). Duloksetyna również poprawia objawy fizyczne w depresji (Detke i wsp., 2002a; 2002b), a zatem łącznie wyniki te wskazują, że leki przeciwdepresyjne, które działają na układ serotoninergiczny i noradrenergiczny, są przydatne w leczeniu fizycznych objawów depresji.
Wiele kwestii związanych z właściwościami przeciwbólowymi leków przeciwdepresyjnych pozostaje niewyjaśnionych. Na przykład, czy działanie przeciwdepresyjne i przeciwbólowe tych związków jest wywierane w równoważnych dawkach? Ogólnie przyjęto, że wszystkie leki przeciwdepresyjne działają przeciwbólowo w dawkach niższych niż te, w których indukowane jest działanie przeciwdepresyjne, co wykazano w przypadku TCA (Lynch, 2001). Jednak nowsze badania nad działaniem przeciwdepresyjnym/analgetycznym SNRI niebędących TCA (wenlafaksyny i duloksetyny) nie potwierdzają tej hipotezy. O ile wenlafaksyna jest skuteczna w leczeniu depresji w dawkach 75-225 mg/dobę (Golden i Nicholas, 2000), o tyle do uśmierzenia bólu wymagane są większe dawki (Briley, 2004; Sumpton i Moulin, 2001), chociaż skuteczne uśmierzenie bólu uzyskano stosując wenlafaksynę w górnym zakresie dawek 150-225 mg/dobę (Rowbotham i wsp., 2004). U ludzi wenlafaksyna hamuje preferencyjnie wychwyt serotoniny w dawce 75 mg/kg, podczas gdy dawki 150 mg/kg hamują wychwyt zarówno serotoniny, jak i noradrenaliny (Roseboom i Kalin, 2000). Dane te są zgodne z danymi przedklinicznymi sugerującymi, że udział obu monoamin jest wymagany do działania przeciwbólowego wenlafaksyny (Berrocoso i in., 2009). Z kolei duloksetyna hamuje wychwyt zwrotny serotoniny i noradrenaliny w podobnych dawkach, a także wywiera działanie przeciwdepresyjne i przeciwbólowe w tym samym zakresie dawek (Brannan i in., 2005; Goldstein i in., 2005). Tak więc TCA wydają się zapewniać skuteczne uśmierzanie bólu przy niższych dawkach niż te, które są wymagane dla ich działania przeciwdepresyjnego, podczas gdy średnie i wysokie dawki SNRI są niezbędne do wytworzenia analgezji (Sansone i Sansone, 2008).
Badania na zwierzętach
Mechanizmy, dzięki którym leki przeciwdepresyjne wywołują efekt przeciwbólowy, były badane głównie na eksperymentalnych modelach zwierzęcych, które odtwarzają zmiany patofizjologiczne występujące u pacjentów cierpiących z powodu bólu (Yalcin i in., 2009b). Chociaż trudno jest opracować modele zwierzęce, które obejmowałyby wszystkie procesy związane z bólem przewlekłym, opracowano różne podejścia metodologiczne w celu modelowania poszczególnych aspektów bólu neuropatycznego, w tym przewlekłe uszkodzenie nerwu kulszowego (Bennett i Xie, 1988) oraz indukcję neuropatii cukrzycowej poprzez podanie streptozotocyny (Jakobsen i Lundbaek, 1976). Te modele zwierzęce pozwalają na określenie progów bólowych w odpowiedzi na różne bodźce bólowe (mechaniczne, termiczne, elektryczne, itp.) i przy zastosowaniu takich metod wykazano, że różne leki przeciwdepresyjne zmniejszają allodynię w modelu neuropatii obwodowej, takie jak desipramina, wenlafaksyna, reboksetyna i nortryptylina (Yalcin i in., 2009a; 2009b). Ponadto, antyalodyniczne działanie amitryptyliny i nortryptylinę (TCAs) opisano w modelach bólu przewlekłego, ale nie ostrego (Benbouzid et al., 2008a), a fluoksetyna (SSRI) okazała się nieskuteczna w stosunkowo wysokich dawkach. Stąd, hamowanie wychwytu zwrotnego serotoniny wydaje się być niewystarczające do złagodzenia allodynii związanej z neuropatią, co stanowi kolejny dowód na przeciwbólowe działanie hamowania wychwytu zwrotnego noradrenaliny (Benbouzid et al., 2008a).
W wielu badaniach wykazano rolę układu monoaminergicznego w analgezji indukowanej przez leki przeciwdepresyjne. Zahamowanie tonusu noradrenergicznego, serotoninergicznego lub dopaminergicznego istotnie osłabia działanie przeciwbólowe leków przeciwdepresyjnych. Na przykład hamowanie hydroksylazy tyrozynowej (enzymu niezbędnego do syntezy noradrenaliny) lub hydroksylazy tryptofanowej (enzymu niezbędnego do syntezy serotoniny) antagonizuje działanie przeciwbólowe leków przeciwdepresyjnych w wielu modelach doświadczalnych (Valverde i in., 1994). Monoaminy działają na wiele podtypów receptorów w układzie nerwowym, z których część pośredniczy w przeciwbólowym działaniu leków przeciwdepresyjnych, takich jak -adrenoceptory (Ghelardini i in., 2000; Yokogawa i in, 2002) i -adrenoceptory (Mico i wsp., 2006b), receptory serotoninowe 5-HT1A, 5-HT2 i 5-HT3 (Bonnefont i wsp., 2005; Yokogawa i wsp., 2002) oraz receptory dopaminowe D2 (Gilbert i Franklin, 2001).
Mechanizm działania przeciwbólowego
Mimo że leki przeciwdepresyjne są stosowane jako leki przeciwbólowe od ponad 40 lat, mechanizm działania leżący u podstaw ich działania przeciwbólowego pozostaje nieznany. Chociaż ich podstawowym działaniem na obwody neuronalne jest zwiększanie dostępności noradrenaliny i/lub serotoniny, proponowano również bezpośredni i pośredni wpływ leków przeciwdepresyjnych na inne układy, w tym na neurotransmisję opioidową. Biorąc pod uwagę ustalone powiązania między bólem przewlekłym a depresją, jest prawdopodobne, że leki przeciwdepresyjne mogą działać na substraty wspólne dla obu tych stanów.
Układ monoaminergiczny
Kilka wspólnych procesów biologicznych ulega deregulacji w depresji i bólu przewlekłym, powodując dysfunkcję osi podwzgórze-przysadka-nadnercza (Blackburn-Munro, 2004), wzrost stężenia cytokin prozapalnych w osoczu (Omoigui, 2007; Raison i in, 2006), zmiany w ekspresji czynnika neurotroficznego pochodzenia mózgowego (BDNF) (Duman i Monteggia, 2006; Geng i in., 2010) i sygnalizacji opioidowej (Gold i in., 1982; Spetea i in., 2002). Niemniej jednak, układ monoaminergiczny jest dominującym biologicznym substratem łączącym oba stany, o czym świadczy kluczowa rola serotoniny i noradrenaliny w bólu i depresji (Gormsen i in., 2006; Robinson i in., 2009). Obserwacje te silnie sugerują, że transmisja bólu może być upośledzona w depresji i vice versa.
Neuroprzekaźniki serotonina i noradrenalina są syntetyzowane głównie w jądrach grzbietowych pnia mózgu, odpowiednio w locus coeruleus i raphe. Projekcje wstępujące z tych dwóch jąder pnia mózgu (głównie do podwzgórza, przedniej części kory zakrętu obręczy i jądra migdałowatego) są zaangażowane w regulację lęku, nastroju i emocji. Co więcej, pogorszenie nastroju wydaje się być związane z upośledzeniem transmisji wzdłuż wstępujących szlaków serotoninergicznych i noradrenergicznych (ryc. 1). Projekcje zstępujące z jąder raphe i locus coeruleus biegną do rdzenia kręgowego (zstępujący szlak bólowy), gdzie wywierają hamujący wpływ na próg bólowy. Ponadto, projekcje z jądra wielkiego (nucleus raphe magnus), jądra współczulnego (locus coeruleus) i A5 (również ośrodek noradrenergiczny) kontrolują uwalnianie serotoniny i noradrenaliny na poziomie rdzenia kręgowego. Ogólną zasadą jest, że w przypadku wzrostu stężenia tych monoamin w szczelinach synaptycznych w obrębie rdzenia kręgowego dochodzi do obniżenia progu bólowego. Należy jednak zaznaczyć, że serotonina może zarówno tłumić, jak i wzmacniać odczuwanie bólu, w zależności od aktywowanych podtypów receptorów. Biorąc pod uwagę wspólne szlaki noradrenergiczne i serotoninergiczne implikowane w przewlekłym bólu i depresji, leki przeciwdepresyjne są najskuteczniejszą metodą leczenia bólu przewlekłego różnego pochodzenia, ze współistniejącą depresją lub bez niej (Blier i Abbott, 2001; Campbell i in., 2003; Mico i in., 2006a). Na poziomie nadrdzeniowym związki te zwiększają poziom noradrenaliny i serotoniny w szczelinach synaptycznych, jednocześnie wzmacniając aktywność zstępujących hamujących szlaków opuszkowo-rdzeniowych, co powoduje analgezję.
Układ opioidowy
W niektórych badaniach przedklinicznych wykazano funkcjonalny związek między endogennymi peptydami opioidowymi a działaniem przeciwbólowym leków przeciwdepresyjnych (tab. 3). Na przykład antagonista opioidowy nalokson lub nor-binaltorfimina antagonizują działanie analgetyczne kilku TCA i inhibitorów wychwytu zwrotnego monoamin w modelach bólu ostrego i przewlekłego (Ardid i Guilbaud, 1992; Valverde i wsp., 1994). Ponieważ układ opioidowy i monoaminergiczny wydają się mieć wspólne mechanizmy molekularne pośredniczące w nocycepcji, związki opioidowe są często podawane razem z lekami przeciwdepresyjnymi w celu uśmierzenia bólu. Jednak zasadność tej strategii terapeutycznej w leczeniu zaburzeń nastroju z towarzyszącym bólem pozostaje niejasna (Alba-Delgado et al., 2011; Berrocoso & Mico, 2009a; 2004; 2009; Rojas-Corrales et al., 2002; 2004). Co więcej, dawki opioidów wymagane do wywołania efektów podobnych do antydepresyjnych są wyższe niż te wymagane do wywołania efektów przeciwbólowych, co sugeruje, że w tych dwóch procesach pośredniczą odrębne mechanizmy (Berrocoso & Mico, 2009a; Rodriguez-Munoz et al., 2011).
Wpływ leków przeciwdepresyjnych na sygnalizację opioidową jest specyficzny dla danego regionu. Istotnie, podawanie leków przeciwdepresyjnych zwiększa gęstość receptorów opioidowych w obszarach mózgu związanych z bólem i depresją (Ortega-Alvaro i in., 2004; Reisine i Soubrie, 1982). Na przykład, przewlekłe podawanie citalopramu zwiększa wiązanie naloksonu w błonach korowych (Antkiewicz-Michaluk i in., 1984), podczas gdy imipramina i fluoksetyna zwiększają ekspresję neuronalnych receptorów μ-opioidowych w korze przedczołowej, hipokampie i putamenie ogoniastym (de Gandarias i in., 1999; 1998). Istnieją dane ujawniające znaczne zróżnicowanie odpowiedzi receptorów opioidowych na leczenie przeciwdepresyjne w zależności od czasu trwania leczenia, dawki, analizowanego obszaru mózgu i sposobu działania leku przeciwdepresyjnego. Co ważne, opioidy mogą również modyfikować działanie leków przeciwdepresyjnych, a u myszy leczonych nieselektywnym antagonistą opioidowym – naloksonem – zaobserwowano znaczne osłabienie behawioralnego działania dwóch TCA, klomipraminy i desipraminy (Devoize i in., 1984). Ten antagonistyczny efekt został potwierdzony w kolejnych badaniach, w których wykazano zmniejszenie skuteczności przeciwdepresyjnej trójpierścieniowych i nietrójpierścieniowych leków przeciwdepresyjnych w odpowiedzi na wstępne leczenie opioidami (Baamonde i in., 1992; Berrocoso i in., 2004; Besson i in., 1999; Tejedor-Real i in., 1995).
Inne zaangażowane mechanizmy
Poza układem monoaminergicznym i opioidowym wydaje się, że niektóre leki przeciwdepresyjne wywierają swój efekt przeciwbólowy działając poprzez inne, mniej znane mechanizmy (patrz przegląd w tabeli 3). Nie jest to zaskakujące, ponieważ w etiopatogenezie bólu, a także w depresji biorą udział inne układy neuroprzekaźnictwa. Większość dowodów wskazuje na udział kanałów jonowych (takich jak wapniowy, potasowy i sodowy) oraz receptorów neuroprzekaźnikowych (kwasu gamma-aminomasłowego (GABA), N-metylo-D-asparaginianu (NMDA) i substancji P) w analgetycznym mechanizmie działania leków przeciwdepresyjnych. Interesujące jest to, że wśród leków przeciwdepresyjnych TCA są tymi, które działają na wiele celów nocyceptywnych zarówno w ośrodku, jak i w otoczeniu.
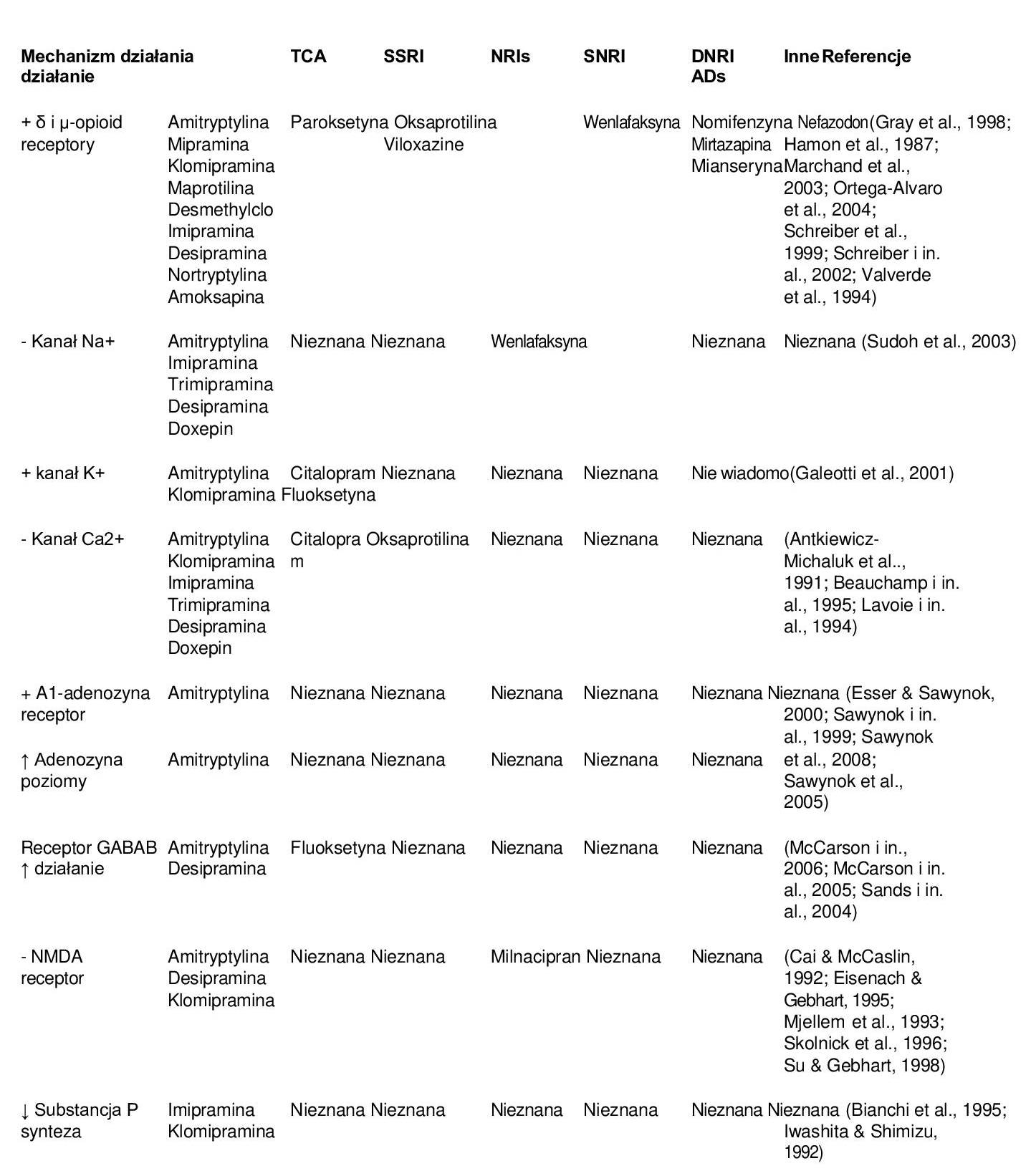
(tab. 3) i być może dlatego TCA wydają się być bardziej skuteczne niż inne leki przeciwdepresyjne o bardziej selektywnym mechanizmie działania monoaminergicznego. Na przykład dla amitryptyliny opisano wiele działań: blokowanie receptorów NMDA i kanałów sodowych (Sudoh i wsp., 2003). Ponadto obniża poziom wapnia wewnątrzkomórkowego w rogu grzbietowym (Cai & McCaslin, 1992), zwiększa poziom adenozyny i aktywność receptora A1 (Esser & Sawynok, 2000; Sawynok et al., 1999; Sawynok et al., 2008; Sawynok et al., 2005). Wreszcie, między innymi, promuje funkcje receptora GABAB (McCarson i in., 2005). Może to pomóc wyjaśnić, dlaczego amitryptylina jest jednym z najczęściej stosowanych leków przeciwdepresyjnych w leczeniu bólu. Należy jednak pamiętać, że wiele z tych celów jest ściśle związanych z układem monoaminergicznym i że działania te mogą ostatecznie prowadzić do zwiększenia stężenia noradrenaliny, serotoniny i dopaminy w szczelinie synaptycznej.
Wnioski wyciągnięte z myszy nokautujących
Ostatnie postępy w dziedzinie genomiki doprowadziły do stworzenia nowych modeli przedklinicznych, w których mutacje są ukierunkowane na konkretne geny. Zastosowanie genetycznie manipulowanych gryzoni, głównie myszy, przyczyniło się do lepszego zrozumienia mechanizmów leżących u podstaw zaburzeń nastroju i bólu oraz mechanizmu działania leków przeciwdepresyjnych. Fenotypy nokautujące (KO) charakteryzowane są za pomocą testów behawioralnych oceniających podstawowy próg nocyceptywny po indukcji bólu i generalnie próg sensoryczny nie ulega zmianie u zwierząt transgenicznych, choć odnotowano pewne wyjątki.
W celu zbadania względnego udziału szlaków serotoninergicznych i noradrenergicznych w analgezji wywołanej lekami przeciwdepresyjnymi wykorzystano myszy typu Knockout (Tabela 4). Stosując rekombinację homologiczną, uzyskano myszy KO pozbawione transportera noradrenaliny (Xu i in., 2000), co skutkuje zmniejszonym wychwytem zwrotnym noradrenaliny. W teście uścisku ogona myszy te wykazywały umiarkowane podwyższenie progu bólu. Ponadto, w przeciwieństwie do myszy typu dzikiego, wstępne leczenie desipraminą nie zwiększało analgezji morfiną u tych mutantów (Bohn i in., 2000), co podkreśla znaczenie transportera noradrenaliny w analgezji wywołanej desipraminą.
U myszy KO badano również rolę innych celów noradrenergicznych w analgezji, w tym rolę – i -adrenoceptorów. Receptory -adrenergiczne są pre- i postsynaptycznymi autoreceptorami, które regulują aktywność neuronów (uwalnianie noradrenaliny, częstotliwość wypalania itd.), a ich aktywacja sprzyja także efektom antynocyceptywnym, uspokajającym i sympatykolitycznym in vivo. Co istotne, agoniści 2-adrenoreceptorów są szeroko stosowani klinicznie w celu naśladowania tych efektów.
Rzeczywiście, analgezja amitryptyliny jest zniesiona w 2A- (Ozdogan i in., 2004), co sugeruje, że 2A-adrenoreceptory odgrywają istotną rolę w pośredniczeniu w ostrym działaniu przeciwbólowym amitryptyliny, chociaż inne układy neuroprzekaźników mogą być również zaangażowane w ten proces. Ekspresja -adrenoceptorów w zstępującej noradrenergicznej ścieżce hamowania (Nicholson i wsp., 2005) również sugeruje rolę tych receptorów w przeciwbólowym działaniu leków przeciwdepresyjnych, a wykazano, że podtyp 2 pełni krytyczną rolę w antyalergicznym działaniu nortryptyliny (Yalcin i wsp., 2009a), wenlafaksyny i desipraminy (Yalcin i wsp., 2009b).
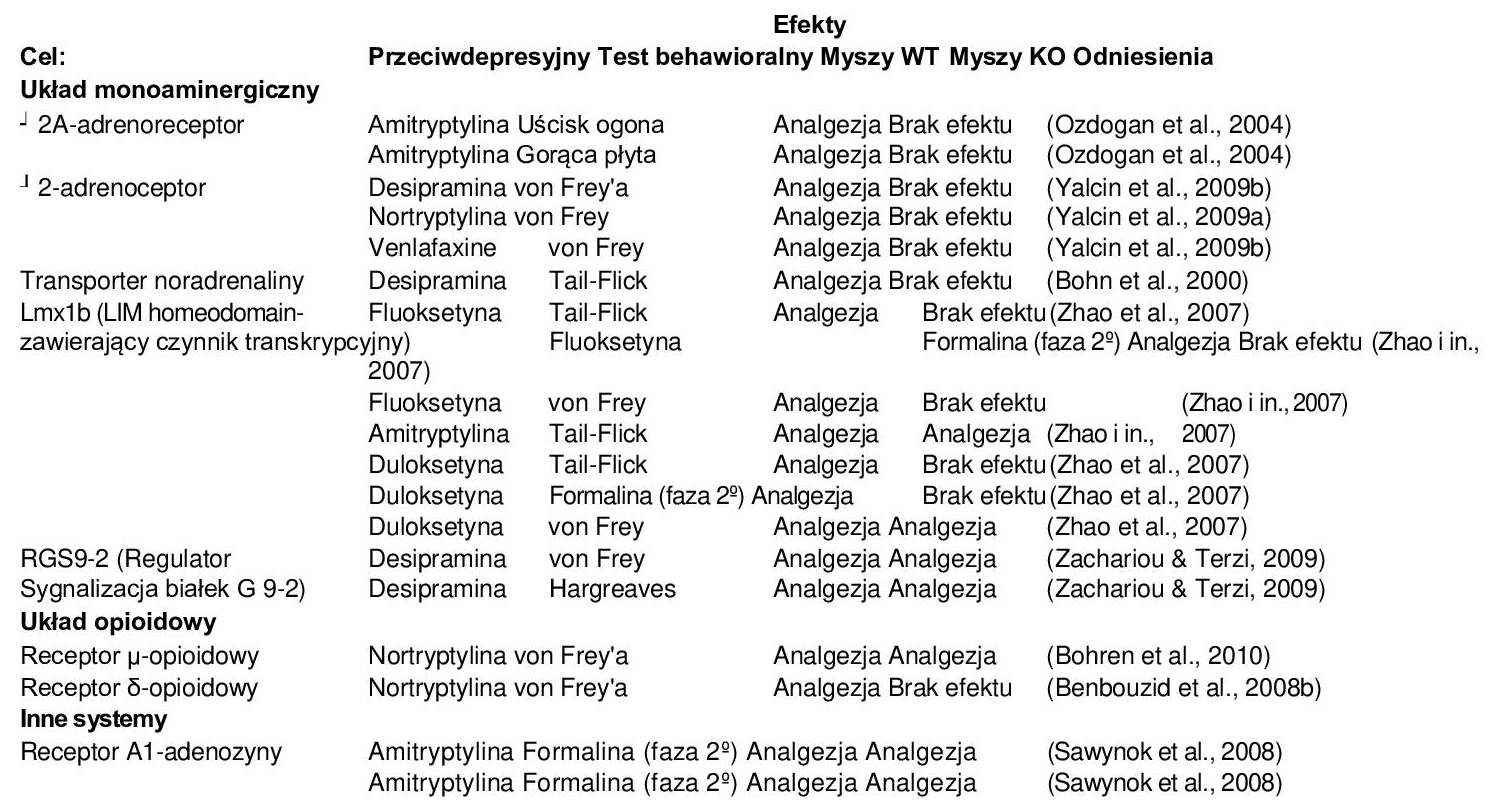
Podczas gdy większość badań nad serotoninergicznym działaniem leków przeciwdepresyjnych koncentrowała się na działaniu przeciwdepresyjnym, analgezja wywołana przez leki przeciwdepresyjne była badana u myszy pozbawionych Lmx1b (Zhao i in., 2007), czynnika transkrypcyjnego zawierającego homeodomeny LIM, wymaganego do postmitotycznego różnicowania neuronów serotoninergicznych (Ding i in., 2003). Myszy te wykazują dysfunkcję centralnej neurotransmisji serotoninergicznej i dlatego stanowią nowe narzędzie do badania sposobu działania leków przeciwdepresyjnych. Rzeczywiście, działanie przeciwbólowe fluoksetyny, amitryptyliny i duloksetyny na ból fazowy i toniczny (testy z formaliną i karagenem) było zniesione lub znacznie osłabione u myszy transgenicznych (Zhao i in., 2007). Dowodzi to udziału neurotransmisji serotoninergicznej w analgezji wywołanej lekami przeciwdepresyjnymi i dostarcza ważnych dowodów genetycznych dotyczących modulacyjnej roli serotoniny w bólu zapalnym i ostrym.
O ile udział noradrenaliny i serotoniny w powstawaniu bólu i depresji jest dobrze poznany, o tyle rola innych układów neuroprzekaźnikowych, w tym układu opioidowego, pozostaje niejasna. Konieczne są dalsze badania, aby wyjaśnić neuroanatomiczne i molekularne powiązania między działaniem przeciwdepresyjnym a sygnalizacją opioidową. Rzeczywiście, kilka badań sugeruje, że działanie to może być pośredniczone ośrodkowo, np. poprzez noradrenergiczne szlaki zstępujące. Stworzenie myszy pozbawionych receptorów μ- (Bohren i in., 2010) i δ-opioidowych (Benbouzid i in., 2008b) zapewniło nowe podejście do analizy zależności między działaniem przeciwdepresyjnym a sygnalizacją opioidową. Przewlekłe leczenie nortryptyliną TCA wywołuje efekt przeciwalergiczny u myszy z neuropatią typu dzikiego i myszy z niedoborem receptorów δ-opioidowych (Benbouzid i in., 2008b; Bohren i in., 2010), ale nie u myszy z niedoborem receptorów μ-opioidowych (Bohren i in., 2010), co wskazuje, że receptory μ-opioidowe nie są wymagane do działania przeciwbólowego nortryptyliny w bólu neuropatycznym. Wyniki te podkreślają różnice funkcjonalne między receptorami opioidowymi μ- i δ- w analgezji indukowanej lekami przeciwdepresyjnymi. Zaproponowano, że działanie przeciwbólowe nortryptyliny może wiązać się z sygnalizacją poprzez endogenny układ opioidowy za pośrednictwem podtypu δ (Benbouzid i wsp., 2008b). Konieczne będą jednak dalsze badania w celu ustalenia, czy podobny mechanizm może leżeć u podstaw działania przeciwdepresyjnego tych związków.
Depresja i ból przewlekły są dwiema wieloaspektowymi chorobami o wspólnym i złożonym podłożu neurobiologicznym. W biologicznym podłożu obu schorzeń bierze udział kilka neuroprzekaźników, jednak głównym szlakiem, na który oddziałują, wydaje się być układ monoaminergiczny. W związku z tym podstawowe podejście terapeutyczne obejmuje stosowanie leków, które działają na ten układ, normalizując poziom monoamin. Leki przeciwdepresyjne, które działają na układ noradrenergiczny i serotoninergiczny są powszechnie stosowane w leczeniu zarówno emocjonalnych, jak i somatycznych objawów depresji, a także są skuteczne jako leki przeciwbólowe w leczeniu przewlekłych form bólu, takich jak ból neuropatyczny. Jednak dalsze badania nad analgetycznym mechanizmem działania leków przeciwdepresyjnych, wykraczającym poza poziom monoaminergiczny, mogą przyczynić się do opracowania nowych opcji terapeutycznych oraz poprawy leczenia i rokowania chorych.
Materiał na warunkach licencji Creative Commons Attribution License (http://creativecommons.org/licenses/by/3.0). Autorzy: Blanca Lorena Cobo-Realpe,Cristina Alba-Delgado,Lidia Bravo,Juan Antonio Mico,Esther Berrocoso
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny













Więcej
Detoks narkotykowy alkoholowy nikotynowy
Lista 100 substancji biochemicznych toksycznych wśród nich nie tylko tal ale leki trudno wykryć
Liczba Lekarzy i Pielęgniarek