Ostatnia aktualizacja 28 lipca 2022
Pacjent przeżył dwa miesiące po pierwszym w swoim rodzaju przeszczepie w Centrum Medycznym Uniwersytetu Maryland o którym pisaliśmy w styczniu 2022.
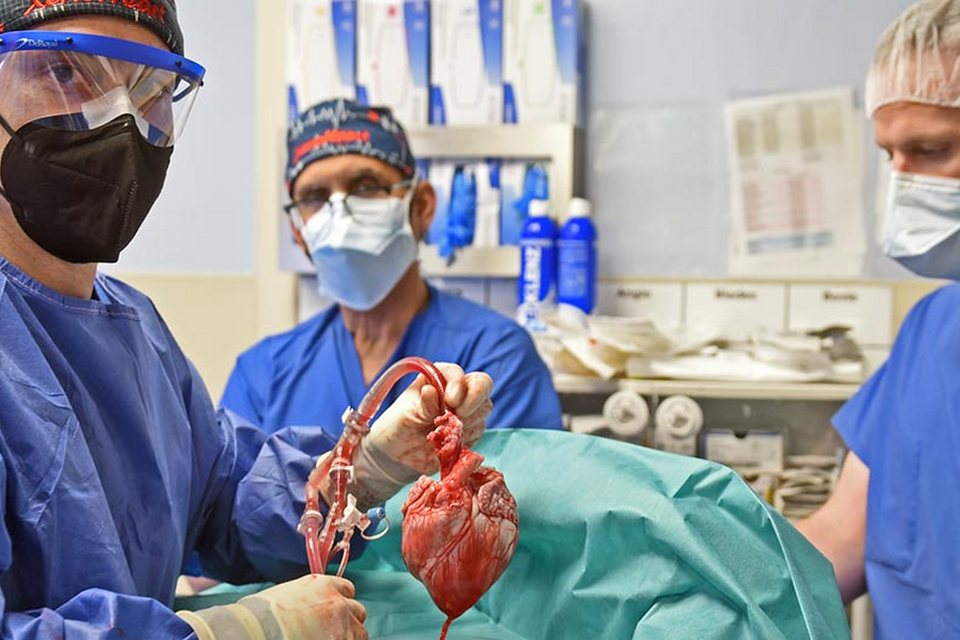
Sześć miesięcy temu chirurdzy-naukowcy z University of Maryland School of Medicine pomyślnie wszczepili genetycznie zmodyfikowane serce świni 57-letniemu pacjentowi z nieuleczalną chorobą serca w ramach pierwszej w swoim rodzaju operacji. Operacja została uznana za wczesny sukces, ponieważ pacjent żył przez dwa miesiące z dobrze funkcjonującym sercem, które nie wykazywało żadnych widocznych oznak odrzucenia, jak wynika z nowej pracy opublikowanej w New England Journal of Medicine (https://www.nejm.org/)
Historyczna operacja ksenotransplantacji została przeprowadzona 7 stycznia 2022 r. przez pracowników University of Maryland School of Medicine (UMSOM) w University of Maryland Medical Center (UMMC), znanym pod wspólną nazwą University of Maryland Medicine. Operacja była jedyną dostępną opcją leczenia pacjenta, Davida Bennetta, który nie kwalifikował się do tradycyjnego przeszczepu serca i był w schyłkowej fazie niewydolności serca, zbliżającej się do końca życia. Procedura została zatwierdzona przez amerykańską Agencję ds. Żywności i Leków w ramach rozszerzonego przepisu o dostępie tzw. „aktu miłosierdzia”.
Przed przeszczepem pan Bennett był przez osiem tygodni przykuty do łóżka z zagrażającą życiu arytmią i został podłączony do urządzenia do omijania płuc i serca, zwanym pozaustrojowym utlenowaniem krwi (ECMO), aby pozostać przy życiu. W ciągu kilku dni po przeszczepie został odstawiony od ECMO i przez blisko dwa miesiące uczestniczył w aktywnej rehabilitacji. Odwiedzał regularnie członków rodziny i śpiewał „America the Beautiful”, oglądając Super Bowl w lutym ze swoim fizjoterapeutą.
“Byliśmy bardzo podbudowani jego postępami. Jego serce było silne, jak na jego wątłe ciało, ale miał silną wolę życia. Powiedział mi, że chciałby wrócić do domu i zobaczyć swojego psa, Lucky’ego” – powiedział współprowadzący badania Bartley Griffith, MD , profesor chirurgii i Thomas E. oraz Alice Marie Hales Distinguished Professor in Transplantation na UMSOM
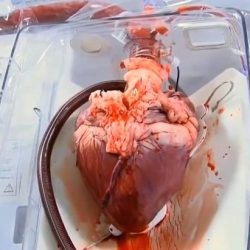
Przeszczepione wieprzowe serce funkcjonowało dobrze przez kilka tygodni i nie wykazywało żadnych typowych oznak odrzucenia przez organizm pacjenta, nawet po dokładnym zbadaniu podczas sekcji zwłok, jak wynika z analizy zamieszczonej w artykule. Chirurdzy doszli do wniosku, że pacjent zmarł z powodu niewydolności serca, która była prawdopodobnie spowodowana wieloma złożonymi czynnikami.
“Jesteśmy bardzo zadowoleni z tego wyniku, ponieważ sugeruje on, że genetycznie zmodyfikowane serce świni oraz eksperymentalny lek, który zastosowaliśmy w celu zapobiegania odrzuceniu przeszczepu, skutecznie współdziałają ze sobą, wykazując, że ksenotransplantacje mogą potencjalnie ratować życie” – powiedział współkierujący badaniem Muhammad M. Mohiuddin, profesor chirurgii i dyrektor naukowy/dyrektor programu ksenotransplantacji serca w UMSOM.
Około 110 000 Amerykanów oczekuje obecnie na przeszczep narządu, a ponad 6000 pacjentów umiera każdego roku przed jego otrzymaniem, jak podaje rządowa strona organdonor.gov. Ksenotransplantacje potencjalnie mogą uratować tysiące istnień ludzkich, ale wiążą się z unikalnym zestawem zagrożeń, w tym możliwością wywołania niebezpiecznej reakcji immunologicznej, która może spowodować odrzucenie narządu przez organizm.
“Nasze wyniki sekcji zwłok nie wykazały dowodów odrzucenia” – powiedział dr Griffith, który jest również dyrektorem klinicznym programu ksenotransplantacji serca w UMSOM. “Zamiast tego zaobserwowaliśmy pogrubienie, a następnie usztywnienie mięśnia sercowego prowadzące do rozkurczowej niewydolności serca, co oznacza, że mięsień sercowy nie był w stanie się rozluźnić i wypełnić serca krwią tak, jak powinien”.
Do rozwoju niewydolności serca mogło się przyczynić kilka czynników, w tym zastosowanie dożylnej immunoglobuliny (IVIG) – leku, który podano pacjentowi dwukrotnie w ciągu drugiego miesiąca po przeszczepie, aby zapobiec odrzuceniu i zakażeniu. Lek ten zawiera przeciwciała przeciwko komórkom świni, które mogły wejść w interakcję ze świńskim sercem, powodując reakcję, która uszkodziła mięsień sercowy. W sercu wykryto również obecność DNA utajonego wirusa świńskiego zwanego cytomegalowirusem świń (pCMV), który został wykryty po raz pierwszy kilka tygodni po operacji, a następnie potwierdzony podczas sekcji narządu.
Prowadzone badania nie znalazły jeszcze dowodów na to, że wirus wywołał infekcję u pacjenta lub zainfekował jakiekolwiek tkanki lub narządy poza sercem. Nie wiadomo, czy utajony wirus uszkodził przeszczepione serce, przyczyniając się do jego niewydolności.
“Uważamy to za ważne doświadczenie edukacyjne” – powiedział dr Mohiuddin. “Wiedząc to, co wiemy teraz, zmienimy niektóre z naszych praktyk i technik w przyszłości”.
Przed zabiegiem dokładnie przestrzegano środków kontroli zakażeń, aby pomóc w zabezpieczeniu się przed znanymi patogenami świń. Świnia-dawca była hodowana w ośrodku stosującym metody opracowane w celu zapobiegania zakażeniu zwierząt-dawców wirusem pCMV i innymi potencjalnymi patogenami. Zdrowa świnia-dawca użyta do ksenotransplantacji została wielokrotnie przebadana pod kątem obecności patogenów. Testy przeprowadzono tuż przed wysyłką do Maryland oraz tuż przed przeszczepem kilka dni później – protokoły te zostały zaakceptowane przez FDA.
“Jako warunek wstępny wydania przez FDA pozwolenia w trybie nagłym opracowaliśmy plan zapobiegania zakażeniom szpitalnym, aby zabezpieczyć się przed przeniesieniem wszelkich znanych lub nieznanych patogenów świń na personel szpitala i innych pacjentów” – powiedział współautor badania, dr Kapil Saharia, MPH, adiunkt w Instytucie Wirusologii Człowieka UMSOM. Plan obejmował specjalne procedury izolacyjne, stosowanie środków ochrony osobistej, specjalne postępowanie z próbkami pobranymi od pacjentów oraz odizolowanie instrumentów medycznych i sprzętu używanego do procedur inwazyjnych. “Praktyki te obowiązywały lekarzy i personel szpitala w czasie, gdy pan Bennett był leczony w Centrum Medycznym Uniwersytetu Maryland” – powiedział dr Saharia, który jest również szefem Wydziału Chorób Zakaźnych Przeszczepów Organów Stałych UMMC.
W związku z planami przyszłych badań klinicznych opracowywane i zatwierdzane są bardziej zaawansowane techniki badawcze, aby mieć pewność, że ten lub jakikolwiek inny wirus nie zostanie niewykryty.
“Byliśmy pionierami, przeprowadzając tę pierwszą na świecie operację, i wiele się nauczyliśmy dzięki temu doświadczeniu” – powiedziała współautorka badania Christine Lau, MD, MBA, profesor dr Robert W. Buxton, kierownik Katedry Chirurgii UMSOM i naczelny chirurg UMMC. “Myślę, że przybliżyliśmy dziedzinę transplantologii o jeden ważny krok do tego, aby stało się to kliniczną rzeczywistością dla potrzebujących pacjentów”.
“Ta publikacja dostarczy istotnych informacji dla społeczności badaczy ksenotransplantów i odegra kluczową rolę w popychaniu tej dziedziny do przodu” – powiedział E. Albert Reece, MD, PhD, MBA, Executive Vice President for Medical Affairs, UM Baltimore oraz John Z. i Akiko K. Bowers Distinguished Professor and Dean, University of Maryland School of Medicine. “Jestem bardzo dumny z historycznych osiągnięć medycznych dokonanych przez tych liderów w swojej dziedzinie i mam nadzieję, że te pierwsze odważne kroki, w tym odwaga pana Bennetta, doprowadzą do długoterminowego rozwiązania, w którym żaden pacjent nie umrze czekając na przeszczep narządu.
“Wyrażam uznanie dla wieloletnich, złożonych badań i niezłomnego zaangażowania, które stoją za tym niezwykłym osiągnięciem naukowym” – powiedział Bert W. O’Malley, MD, Prezes i Dyrektor Generalny, University of Maryland Medical Center. “Wkroczyliśmy w nową erę w transplantacji narządów. Wprawdzie przed nami jeszcze długa droga, zanim ksenotransplantacja stanie się codziennością, ale ta historyczna operacja przybliża nam przyszłość, o której wielu z nas nigdy nie myślało, że jest możliwa.”
“Ta recenzowana publikacja stanowi kulminację ponad dwóch dekad pracy naukowców Revivicor i zapewnia najgłębszy jak dotąd wgląd w to, jak ksenotransplantacja może skutecznie rozwiązać problem krytycznego niedoboru tolerowanych, nadających się do przeszczepu narządów” – powiedział współautor badania David Ayares, PhD, prezes i dyrektor naukowy Revivicor, Inc. UMSOM otrzymał sponsorowany grant badawczy o wartości 15,7 mln USD na ocenę genetycznie zmodyfikowanych serc świńskich UHearts™ firmy Revivicor w badaniach na pawianach. “Nauka płynąca z tej procedury, teraz dostępna dla światowej społeczności naukowej dzięki bezinteresownemu darowi pana Bennetta i jego rodziny, przybliża nas o krok do ratowania niezliczonych istnień ludzkich w przyszłości.”
Źródło: medschool.umaryland.edu (z foto)
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny









Więcej
W Polsce brakuje cukru i drożeje? On był jest i będzie tani dla zdrowia. Nie przepłacaj
Likwidowanie ciężkiego bólu bez leków? Już to możliwe
Uważaj z kim się całujesz kogo ssiesz lub kto ciebie liże aby nie skończyło się zarażeniem