
Ostatnia aktualizacja 28 lipca 2022
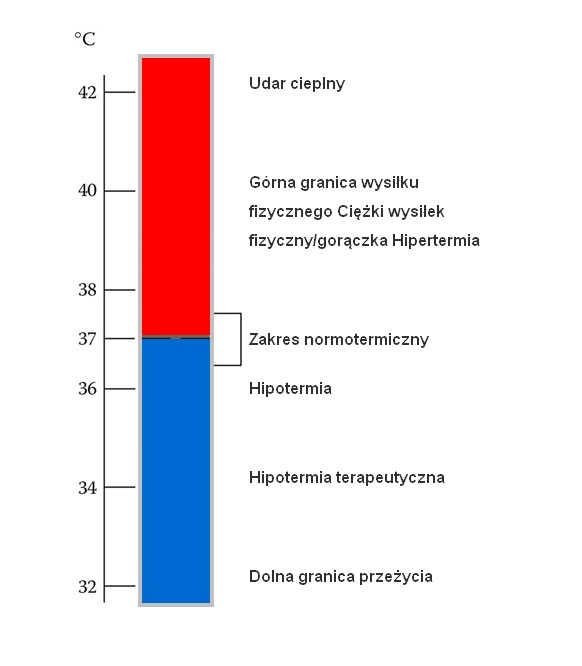
Dynamiczny wysiłek fizyczny wywołuje produkcję ciepła metabolicznego w ćwiczących mięśniach, co w konsekwencji podnosi temperaturę ciała. Układ termoregulacyjny odprowadza to ciepło, aby utrzymać temperaturę ciała w wąskich granicach (rysunek 1). Znaczenie tych mechanizmów ilustruje obliczenie, że gdyby ciepło nie było uwalniane ze skóry, temperatura wewnętrzna osiągnęłaby górną bezpieczną granicę w ciągu 10 minut umiarkowanego wysiłku. Nawet osoby dobrze wytrenowane nie są skłonne do kontynuowania ćwiczeń, gdy temperatura wewnętrzna ciała przekracza 40°C. Wiele czynników moduluje mechanizmy termoregulacyjne podczas długotrwałego wysiłku. Wzrost temperatury poza tym wąskim zakresem nie tylko wpływa na wydolność wysiłkową, ale może być zagrożeniem życia. Komplikacje te mogą być nasilone u osób z upośledzonym układem termoregulacji. Głównym celem tego rozdziału jest omówienie ostatnich postępów w zrozumieniu reakcji termoregulacyjnych, na które wpływają czynniki związane z wysiłkiem fizycznym, skupiając się na ludzkim poceniu się i krążeniu skórnym. W rozdziale tym omówiono również wpływ warunków fizjologicznych (w tym stanu płynów ustrojowych) i zdrowotnych na te reakcje termoregulacyjne.
Podwyższona temperatura ciała, zarówno w wyniku aktywnego, jak i pasywnego stresu termicznego, jest przenoszona do środowiska przez mechanizmy nie parującej i parującej utraty ciepła. Mechanizmy nie parującej utraty ciepła (tj. suchej utraty ciepła) obejmują przewodzenie, konwekcję i promieniowanie, a u ludzi są one dominującymi mechanizmami utraty ciepła w spoczynku. Skuteczność tych mechanizmów zależy od gradientu temperatury pomiędzy otoczeniem a skórą. Temperatura skóry jest regulowana przede wszystkim przez zwiększenie/zmniejszenie przepływu krwi do skóry, co umożliwia przekazywanie ciepła z wewnętrznego rdzenia ciała do otoczenia. Mechanizmy ewaporacyjnej utraty ciepła obejmują zwiększoną wentylację (np. dyszenie), rozprowadzanie śliny i pocenie się. Podczas gdy u innych ssaków i ptaków ewaporacyjna utrata ciepła może odbywać się poprzez dyszenie lub rozprowadzanie śliny (Robert Shaw 2006), u ludzi dominującym mechanizmem odprowadzania ciepła jest pocenie się połączone ze zwiększonym rozszerzeniem naczyń skórnych (White 2006).
Dynamiczny wysiłek fizyczny gwałtownie zwiększa tempo metabolicznej produkcji ciepła, co wymaga natychmiastowego i skutecznego jego odprowadzenia. Równowaga pomiędzy wytwarzaniem i odprowadzaniem ciepła określa zapotrzebowanie na ciepło ewaporacyjne danej osoby. Podczas gdy większa szybkość metabolicznej produkcji ciepła wymaga zwiększonej zdolności do pocenia się, produkcja potu jest ograniczona. Obfite pocenie się może być problematyczne w utrzymaniu równowagi płynów, ponieważ regulacja płynów ustrojowych koliduje z tą ewaporacyjną utratą ciepła. Ponadto na rozpraszanie ciepła, czy to w sposób nieewaporacyjny, czy też ewaporacyjny, mają również wpływ warunki środowiskowe. W warunkach, w których temperatura otoczenia jest wyższa niż temperatura skóry, pocenie się staje się bardziej istotne dla odprowadzania ciepła u ludzi. Jednakże, ewaporacyjna utrata ciepła w nadmiernie wilgotnym środowisku w danej temperaturze jest mniej efektywna, co zwiększa zależność od nieewaporacyjnej utraty ciepła poprzez skórne rozszerzenie naczyń krwionośnych. I odwrotnie, podczas gdy dynamiczne ćwiczenia wymagają dystrybucji przepływu krwi w kierunku aktywnych mięśni, zwiększona temperatura rdzenia generowana przez aktywne mięśnie wymaga również zwiększonego przepływu krwi do skóry w celu rozproszenia ciepła, tworząc konkurencyjne wpływy w obrębie układu sercowo-naczyniowego. Biorąc pod uwagę te czynniki, przedstawimy szczegółowo fizjologiczne mechanizmy pocenia się i skórnego przepływu krwi podczas wysiłku.
Choroby i urazy mogą również prowadzić do upośledzenia termoregulacji, co może wpływać na jakość życia poprzez ograniczenie zdolności do tolerowania wysiłku fizycznego, jak również stwarzać dodatkowe ryzyko wystąpienia choroby związanej z upałem. Upośledzenia te nasilają się, gdy aktywność fizyczna wykonywana jest w ekstremalnych warunkach środowiskowych (wysoka temperatura otoczenia i wysoka wilgotność względna). Choroby i urazy mogą wpływać na neuronalną kontrolę termoregulacji, jak również na fizyczne zaburzenie struktur rozpraszających ciepło w skórze (tj. skórnych naczyń krwionośnych i gruczołów potowych). Zrozumienie fizjologicznych i fizycznych cech dysfunkcji termoregulacji w chorobie i urazie doprowadziło do opracowania interwencji i strategii, które umożliwiają osobom z chorobą lub urazem nie tylko wykonywanie rutynowych czynności życia codziennego, ale także czerpanie korzyści z ćwiczeń fizycznych.
Neuronalna kontrola pocenia się i przepływu krwi w skórze
Ośrodek termoregulacji znajduje się w przedoptycznych okolicach podwzgórza w mózgu, integrując informacje termiczne wykrywane w ośrodkowym układzie nerwowym w połączeniu z informacjami przekazywanymi z termoreceptorów skóry i rdzenia (Aronsohn i Sachs 1885; Kahn 1904; Moorhouse 1911; Ott 1877). Identyfikacja szlaków neuronalnych odpowiedzialnych za pocenie się lub skórne aktywne rozszerzenie naczyń u ludzi jest trudna i dlatego dokładne szlaki neurologiczne nie są do końca poznane. Na podstawie danych pochodzących zarówno z badań na zwierzętach, jak i danych anatomicznych u ludzi (Kuno 1956; Low 2004; Nakamura i wsp. 2004; Sato i wsp. 1989) uważa się, że droga neuronalna z mózgu do narządów termoregulacji jest następująca: sygnały eferentne z obszaru przedwzrokowego w podwzgórzu wędrują przez tegmenmmę ponsa i obszary raphe medullary raphe do pośrednio-bocznej kolumny komórkowej rdzenia kręgowego. W rdzeniu kręgowym neurony wychodzą z rogu brzusznego, przechodzą przez ramię białe (ramus communicans), a następnie tworzą synapsy w zwojach współczulnych. Postganglionowe, niezmielinizowane włókna C (tj. nerwy współczulne skóry) przechodzą przez ramus communicans szary, łączą się z nerwami obwodowymi i wędrują do gruczołów potowych i naczyń skórnych, przy czym te włókna nerwowe oplatają tkankę okołogruczołową narządów docelowych (Uno 1977). Nerwy współczulne skóry odgrywają rolę w kontroli zarówno pocenia się, jak i przepływu krwi przez skórę. Neuronalne unerwienie współczulne narządów termoregulacyjnych jest złożone. Pocenie się jest regulowane przez współczulny cholinergiczny układ sudomotoryczny, podczas gdy skórny przepływ krwi jest regulowany zarówno przez współczulny adrenergiczny układ wazokonstrykcyjny, jak i oddzielny współczulny nieadrenergiczny układ wazodylatacyjny. Aktywacja układu cholinergicznego
Nerwy cholinergiczne zwiększają zarówno pocenie się, jak i rozszerzenie naczyń skórnych, co potwierdza blokowanie uwalniania neuroprzekaźnika z nerwów cholinergicznych za pomocą toksyny botulinowej. Nie wiadomo jednak, czy gruczoły potowe i naczynia skórne mają wspólne unerwienie przez nerwy cholinergiczne, czy też są unerwione oddzielnie, zważywszy na różny czas rozpoczęcia i przeciwstawne odpowiedzi efektorowe, obserwowane zwłaszcza podczas wysiłku (Johnson i Proppe 1996).
Podstawowym neuroprzekaźnikiem dla nerwów adrenergicznych i cholinergicznych jest odpowiednio noradrenalina i acetylocholina. Oprócz każdego z pierwotnych neuroprzekaźników w odpowiedzi termoregulacyjnej biorą udział ko-transmitery uwalniane z nerwów współczulnych. Neuropeptyd Y, ko-transmiter z nerwów adrenergicznych, również przyczynia się do aktywnego skurczu naczyń skórnych podczas ekspozycji na zimno (Stephens i wsp. 2004). Podczas gdy skórna aktywna wazodylatacja jest kontrolowana neuronalnie przez nerwy cholinergiczne, jest ona również modulowana przez wiele innych kofaktorów, w tym tlenek azotu (NO), wazoaktywny peptyd jelitowy, prostaglandyny i substancję P (Charkoudian 2010; Holowatz i Kenney 2010; Johnson i Kellogg 2010; Kellogg 2006). Obecnie grupy badawcze zajmują się dalszym wyjaśnianiem mechanizmów odpowiedzialnych za regulację pocenia się i skórnego przepływu krwi.
Ocena reakcji termoregulacyjnych
Nielsen (1938) wykazał, że temperatura wewnętrzna wzrasta na początku dynamicznego wysiłku fizycznego i w miarę jego trwania utrzymuje się na wyższym poziomie w stosunku do wartości sprzed wysiłku. Nielsen i Nielsen (1965) wykazali, że wielkość podwyższonej temperatury wewnętrznej spowodowanej wysiłkiem fizycznym była proporcjonalna do intensywności pracy w różnych warunkach środowiskowych (5°C-30°C). Natężenie wydzielania potu podczas wysiłku fizycznego w stanie ustalonym na każdym poziomie pracy ściśle podążało za wzrostem temperatury wewnętrznej. Tak więc, tempo ewaporacyjnej utraty ciepła jest określane przez zapotrzebowanie na ewaporacyjną utratę ciepła (Gagnon i Kenny 2012). W środowisku, które pozwala na odpowiednie parowanie, tempo ewaporacyjnej utraty ciepła jest określane przez parowanie wymagane dla równowagi cieplnej, dopóki to wymaganie nie przekroczy maksymalnej zdolności pocenia się danej osoby (Gagnon, Jay i Kenny 2013).
Reakcje termoregulacyjne, w tym pocenie się, rozszerzenie i zwężenie naczyń skórnych oraz termogeneza bezdrżeniowa w brunatnej tkance tłuszczowej, są przede wszystkim kontrolowane przez czynniki termiczne zintegrowane w okolicy przedwzrokowej podwzgórza (Nakamura i Morrison 2008, 2010). Pod koniec lat 60. XX wieku Benzinger (1969) jako pierwszy opisał tę dynamiczną zależność pomiędzy temperaturą ciała a reakcjami termoregulacyjnymi w różnych temperaturach środowiska. Na podstawie tych badań można opisać reakcje termoregulacyjne poprzez wyrażenie wzrostu pocenia się i rozszerzenia naczyń skórnych w funkcji średniej temperatury ciała, obliczonej za pomocą ważonej sumy temperatury wewnętrznej i temperatury skóry (Nadel i wsp. 1971; Saltin, Gagge i Stolwijk 1970). Zmiany w odpowiedziach termoregulacyjnych mogą być obserwowane przy danym poziomie średniej temperatury ciała i wzrastają proporcjonalnie do wzrostu średniej temperatury ciała. W efekcie, odpowiedzi te mogą być scharakteryzowane przez progi temperatury odpowiadające początkowi pocenia się i/lub skórnej wazodylatacji oraz wrażliwości na pocenie się i/lub skórną wazodylatację – związek między zmianą temperatury wewnętrznej a zmianą odpowiedzi na pocenie się i/lub skórną wazodylatację.
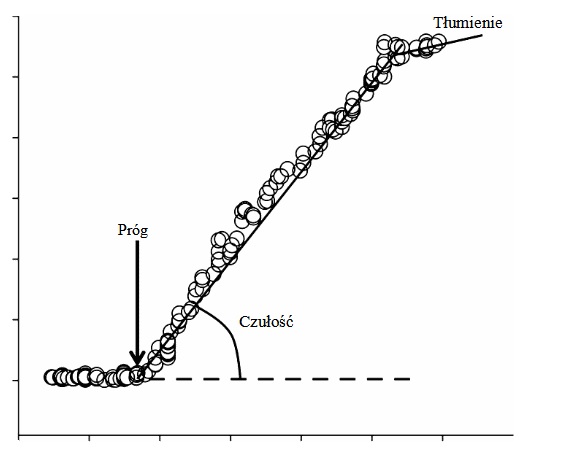
Podczas dynamicznego wysiłku fizycznego, tempo metabolicznej produkcji ciepła wzrasta natychmiast, tworząc dysproporcję z rozpraszaniem ciepła. Dlatego progi początku pocenia się i/lub rozszerzenia naczyń skórnych są przesunięte w prawo w kierunku wyższej średniej temperatury ciała w stosunku do pasywnego stresu cieplnego. Inne czynniki, które wpływają na progi utraty ciepła i wrażliwość na nie, to nawodnienie, obciążenie baroreceptorów, rytm okołodobowy, cykl menstruacyjny, trening/detrening, aklimatyzacja cieplna i starzenie się.
Czynniki modyfikujące kontrolę pocenia się i przepływu krwi przez skórę
Dynamiczny wysiłek fizyczny natychmiast i szybko generuje ciepło w aktywnych mięśniach. Pocenie się występuje natychmiast na początku dynamicznych ćwiczeń w ciepłych warunkach otoczenia, przed jakimkolwiek mierzalnym wzrostem temperatury wewnętrznej, co sugeruje, że czynniki nietermiczne związane z wysiłkiem przyczyniają się do zwiększenia pocenia się (van Beaumont i Bullard 1963). W przeciwieństwie do tego, skórny przepływ krwi zmniejsza się niezależnie od warunków termicznych podczas dynamicznego wysiłku (Christensen, Nielsen i Hannisdahl 1942; Johnson i Park 1982; Taylor i wsp. 1984). Kellogg i wsp. (1991) wykazali, że skórne zwężenie naczyń krwionośnych na początku dynamicznego wysiłku fizycznego jest spowodowane przez
wzrost aktywności neuronów wazokonstrykcyjnych. Głównym wnioskiem z tych badań jest to, że nietermiczne czynniki związane z początkiem dynamicznego wysiłku modulują odpowiedzi termoregulacyjne. Podobne wnioski wyciągnięto z badań, w których badani jeździli na ergometrze z obciążeniem zmieniającym się w sposób sinusoidalny, a odpowiedzi termoregulacyjne podążały za sinusoidalnym wzorcem wysiłku, a nie za zmianami temperatury wewnętrznej lub skóry (Yamazaki 2002; Yamazaki, Sone i Ikegami 1994). Ponadto, w miarę trwania ćwiczeń, układ sercowo-naczyniowy i układ płynów ustrojowych interweniują w odpowiedzi termoregulacyjne w celu utrzymania tych systemów regulacyjnych. Celem tej części rozdziału jest podsumowanie podstawowych nietermicznych czynników modyfikujących szybkość pocenia się i skórny przepływ krwi podczas wysiłku.
Czynniki związane z wysiłkiem fizycznym
Johansson (1895) postulował, że dwa oddzielne i odrębne mechanizmy neuronalne kontrolują reakcje sercowo-naczyniowe podczas wysiłku. Jeden z mechanizmów dominujących w odpowiedzi sercowo-naczyniowej wypromieniowuje impulsy z kory ruchowej w ośrodkowym układzie nerwowym. Krogh i Lindhard (1913) określili ten centralny mechanizm jako napromieniowanie kory, a później zdefiniowali go jako centralne dowodzenie (Goodwin, McCloskey i Mitchell 1972). Drugi mechanizm, wysiłkowy odruch uciskowy, pochodzi z pobudzenia aferentnych zakończeń nerwowych w mięśniu szkieletowym i jest uruchamiany podczas skurczu mięśnia (Alam i Smirk 1937). Odruch wysiłkowy może być wywołany przez nerwy dośrodkowe wrażliwe na bodźce mechaniczne (mechanoreceptory) i/lub nerwy dośrodkowe wrażliwe na bodźce meta- boliczne (metaboreceptory) (Mitchell 1990).
Istnieje wiele metod eksperymentalnych pozwalających na identyfikację i określenie roli centralnego sterowania i obwodowych receptorów aferentnych podczas ćwiczeń. Aktywna jazda na rowerze bez obciążenia może być wykorzystana do badania wpływu centralnego sterowania. Jednakże, zmiany w odpowiedzi termoregulacyjnej podczas jazdy bez obciążenia są dość małe (Kondo i wsp. 1997). Częściowa blokada nerwowo-mięśniowa może być również wykorzystana do wyraźnego wykazania wpływu centralnego polecenia (Iwamoto i wsp. 1987; Leonard i wsp. 1985; Mitchell 1985). Wpływ centralnego sterowania na reakcje termoregulacyjne badano również podczas izometrycznych ćwiczeń chwytnych z zastosowaniem częściowej blokady nerwowo-mięśniowej (Shibasaki i wsp. 2003, 2005). W badaniach tych badani nie byli w stanie utrzymać pożądanej siły skurczu po podaniu środka blokującego mięśnie nerwowe, ale kontynuowali próbę wykonania ćwiczenia przez okres 2 minut. Mimo że produkcja siły była bliska zeru, częstość akcji serca i ciśnienie krwi wzrastały podczas ćwiczeń. Częstość pocenia się była zwiększona, ale skórne przewodnictwo naczyniowe (CVC), pomiar skórnego przepływu krwi, było zmniejszone w tym okresie ćwiczenia, co sugeruje, że zarówno pocenie się, jak i skórny przepływ krwi mogą być modulowane przez czynniki związane z centralnym dowodzeniem. Jednakże zmiana w CVC była obserwowana tylko wtedy, gdy badani byli poddani stresowi cieplnemu. Crandall i wsp. (1995, 1998) zaobserwowali zmniejszenie CVC w miejscu, w którym zniesiono wazokonstrykcję adrenergiczną (poprzez leczenie bretylium) oraz w sąsiednim, nieleczonym miejscu, co sugeruje, że obserwowane zmniejszenie CVC nastąpiło poprzez wycofanie aktywnej wazodylatacyjnej aktywności nerwowej. Z drugiej strony, Kellogg i wsp. (1991) wykazali, że skórne zwężenie naczyń na początku dynamicznego wysiłku fizycznego jest spowodowane zwiększonym aktywnym tonem wazokonstrykcyjnym, niezależnie od stanu termicznego. Tak więc, skórny wazokonstrykcja następuje poprzez różnice w kontroli neuronalnej w zależności od rodzaju ćwiczeń (statyczne lub dynamiczne). Podobnie wpływ centralnego dowodzenia na skurcz naczyń skórnych jest różny podczas ćwiczeń dynamicznych w porównaniu z ćwiczeniami izometrycznymi. Friedman i wsp. (1991) oceniali udział centralnego dowodzenia poprzez spowodowanie redukcji skórnych odpowiedzi wazokonstrykcyjnych na początku dynamicznych ćwiczeń u normotermicznych osób po podaniu kurary. Pomimo zwiększenia centralnego dowodzenia przez kurarę podczas ćwiczeń dynamicznych o niskiej intensywności, nie zaobserwowano typowego zmniejszenia CVC na początku ćwiczeń dynamicznych, co sugeruje, że skurcz skórnych naczyń krwionośnych na początku ćwiczeń dynamicznych nie jest spowodowany aktywacją centralnego dowodzenia. Podsumowując, centralne polecenie zwiększa pocenie się i skórny skurcz naczyń w wyniku wycofania aktywnej wazodylatacji, a nie zwiększonego aktywnego skurczu naczyń.
W celu stymulacji metaboreceptorów mięśniowych można wykorzystać powysiłkowe niedokrwienie poprzez okluzję mankietu lub dodatnie ciśnienie w czynnych mięśniach. Alam i Smirk (1937) wykazali, że ciśnienie krwi wzrasta podczas dynamicznego wysiłku i pozostaje podwyższone po okluzji krążenia kończyn. Po zwolnieniu okluzji ciśnienie krwi wracało do poziomu sprzed ćwiczeń. Obserwacje te doprowadziły do licznych badań nad rolą metaboreceptorów mięśniowych w modulowaniu ciśnienia tętniczego w czasie wysiłku. Wykorzystując tę perturbację, określono możliwą rolę metaboreceptorów w modulowaniu reakcji pocenia się podczas wysiłku. Tempo wydzielania potu wzrastało podczas izometrycznych ćwiczeń z uchwytem dłoni i pozostawało podwyższone podczas isch- emii powysiłkowej; tempo wydzielania potu powracało do poziomu sprzed wysiłku wraz ze zdjęciem mankietu (Crandall, Stephens i Johnson 1998; Kondo i wsp. 1999; Shibasaki, Kondo i Crandall 2001). Obserwacje te sugerują, że aktywacja metaboreceptorów jest zdolna do modulowania szybkości wydzielania potu podczas izometrycznych ćwiczeń chwytnych. Jednakże, ciśnienie krwi również wzrosło podczas ćwiczeń izometrycznych i pozostało podwyższone w czasie powysiłkowego niedokrwienia, co nasuwa pytanie, czy wzrost pocenia się podczas ćwiczeń izometrycznych i następującego po nich powysiłkowego niedokrwienia nie nastąpił w wyniku obciążenia baroreceptorów, a nie aktywacji metaboreceptorów. Aby wyeliminować wpływ obciążenia baroreceptorów, podwyższone ciśnienie krwi w okresie niedokrwienia powysiłkowego zostało przywrócone do poziomu przed wysiłkiem poprzez dożylny wlew nitroprusydku sodu. Pomimo obniżenia ciśnienia krwi, ilość wydzielanego potu pozostawała podwyższona przez cały okres niedokrwienia, podobnie jak w przypadku podwyższonego ciśnienia krwi (Shibasaki, Kondo, i Crandall 2001). Dalsze badania wykazały podobne reakcje pocenia się podczas ćwiczeń z uchwytem dłoni i powysiłkowego niedokrwienia podczas poddawania dolnego podciśnienia ciała (LBNP) w celu obniżenia wysiłkowego ciśnienia krwi (Binder i wsp. 2012). Łącznie badania te wskazują, że wzrost częstości pocenia się podczas ćwiczeń izometrycznych i powysiłkowego niedokrwienia następuje poprzez aktywację metaboreceptorów niezależnie od zmian ciśnienia tętniczego.
CVC podczas izometrycznych ćwiczeń dłoni nie zmienia się w normotermii, ale zmniejsza się w warunkach ciepła. Zmniejszenie to następuje w wyniku wycofania się aktywnej wazodylatacji skórnej (Crandall, Stephens i Johnson 1998; Crandall i wsp. 1995). Crandall i wsp. (1998) stwierdzili, że CVC pozostaje zmniejszona podczas niedokrwienia po wysiłku, a następnie powraca do poziomu sprzed wysiłku po ustąpieniu niedokrwienia. Stwierdzili oni, że obserwowane zmniejszenie CVC podczas ćwiczeń izometrycznych w warunkach stresu cieplnego może być spowodowane stymulacją metaboreceptorów mięśniowych. Zastosowanie niższych
Binder i wsp. (2012) stwierdzili, że baroreceptory przyczyniają się również do indukowanego przez metaboreceptory skurczu naczyń skórnych. Ten udział baroreceptorów obserwowano tylko podczas hipertermii, ale nie w normotermii. McCord i Minson (2005) wykazali jednak, że zmniejszenie CVC podczas izometrycznych ćwiczeń z hantlami jest związane z początkowym poziomem skórnego przepływu krwi przed rozpoczęciem ćwiczeń, ponieważ CVC początkowo zwiększone przez miejscowe ogrzewanie zostało zmniejszone przez ćwiczenia, co sugeruje, że obserwowane skórne zwężenie naczyń podczas izometrycznych ćwiczeń z hantlami u osób poddanych stresowi cieplnemu jest związane z mechanizmem nieneuronalnym. Wykorzystując blokadę nerwu pachowego, Shibasaki i wsp. (2009) wykazali później, że mechanizmy neuronalne i nieneuronalne przyczyniają się do zmniejszenia CVC podczas izometrycznych ćwiczeń ręcznych w stresie cieplnym. Podsumowując, modulacja CVC przez metaborefleks mięśniowy występowała tylko u osób poddanych stresowi cieplnemu, ale skórne zwężenie naczyń jest częściowo związane z mechanizmami nieneuronalnymi.
Bierny ruch kończyn może być wykorzystany do selektywnej stymulacji mechanoreceptorów mięśniowych. Kondo i wsp. (1997) zaobserwowali wzrost ilości wydzielanego potu podczas 2-minutowej sesji biernych ruchów kończyn u lekko rozgrzanych osób z wcześniej stabilnym poziomem wydzielania potu. Jednak wzrost ilości potu podczas tej procedury był dość niewielki, co powodowało trudności w ustaleniu, czy ta zmiana ilości potu była spowodowana stymulacją mechanoreceptorów, czy też wynikała ze spontanicznych fluktuacji ilości potu (tj. nie przypisywanych stymulacji mechanoreceptorów). Carter i wsp. (2002) po umiarkowanym wysiłku fizycznym w pozycji wyprostowanej przeprowadzili badanie w warunkach jazdy na rowerze bez obciążenia (tj. 0 W) i regeneracji bez pedałowania. Tempo wydzielania potu i CVC podczas jazdy na rowerze bez obciążenia (tj. 0 W) były większe w porównaniu z sytuacją, gdy badani nie pedałowali podczas odpoczynku. W kolejnym badaniu Wilson i wsp. (2004) przeprowadzili podobny protokół z uczestnikami w pozycji leżącej, aby zminimalizować rozładowanie baroreceptorów związane z odpoczynkiem w pozycji stojącej. Podobnie do poprzednich wyników, częstość pocenia się pozostawała podwyższona podczas pedałowania bez obciążenia w porównaniu z sytuacją, gdy badani nie pedałowali. W przeciwieństwie do tego, nie zaobserwowano różnic w CVC pomiędzy aktywną jazdą na rowerze a jazdą bez pedałowania. Biorąc pod uwagę fakt, że aktywna jazda na rowerze obejmuje zarówno aktywację centralnego sterowania, jak i stymulację mechanoreceptorów mięśniowych, przypuszczają oni, że centralne sterowanie lub stymulacja mechanoreceptorów moduluje tempo pocenia się podczas powrotu do stanu sprzed wysiłku. Używając ergometru rowerowego w tandemie, zbadano rolę mechanoreceptorów na szybkość wydzielania potu i CVC po umiarkowanym wysiłku fizycznym, podczas gdy badani pozostawali w pozycji siedzącej, a druga osoba na ergometrze rowerowym w tandemie jeździła za nich podczas odpoczynku (Journeay i wsp. 2004; Shibasaki i wsp. 2004). W ten sposób mechanoreceptory mięśniowe były stymulowane pasywnie przez ruch drugiej osoby, co eliminowało centralne sterowanie. Ta stymulacja mechanoreceptorów mięśniowych podczas pasywnej jazdy na rowerze modulowała szybkość pocenia się, bez wpływu na CVC. Łącznie, wyniki te sugerują, że stymulacja mechanoreceptorów mięśniowych jest w stanie modulować szybkość pocenia się, ale nie CVC.
Odruchy z baroreceptorów
Kontrola naczyń skórnych przez odruchy baroreceptorowe jest powszechnie znana (Johnson 1986, 2010), ale wpływ odruchów baroreceptorowych na pocenie się nie jest w pełni wyjaśniony. Baroreceptory (sercowo-płucne, aortalne i szyjne) są kluczowe dla regulacji ciśnienia krwi głównie poprzez neuronalną kontrolę częstości akcji serca i naczyń krwionośnych.
Do eksperymentalnego badania funkcji baroreceptorów wykorzystano obciążanie lub odciążanie baroreceptorów poprzez zmiany postawy ciała (w pozycji stojącej lub leżącej), symulację krwotoku (LBNP), ucisk/odsysanie kołnierza szyjnego, transfuzje i/lub środki farmakologiczne.
Johnson i Park (1981) porównywali progi temperatury wewnętrznej dla rozszerzenia naczyń skórnych podczas następujących warunków: pasywne ogrzewanie w pozycji leżącej, pasywne ogrzewanie w pozycji stojącej, ćwiczenia w pozycji leżącej i ćwiczenia w pozycji stojącej. Zarówno pozycja stojąca, jak i ćwiczenia fizyczne przyczyniły się do podwyższenia progu temperatury wewnętrznej dla skórnego rozszerzenia naczyń. Ponadto zmniejszenie objętości krwi i LBNP opóźniają początek wazodylatacji skórnej podczas dynamicznych ćwiczeń w pozycji leżącej (Mack, Cordero i Peters 2001; Mack, Nose i Nadel 1988; Nishiyasu, Shi i Mack 1991). Z drugiej strony, wpływ rozładowania baroreceptorów na pocenie się był niespójny. Johnson i Park (1981) nie stwierdzili różnic w progu temperatury wewnętrznej dla pocenia się podczas ćwiczeń w pozycji stojącej lub nieznacznie niższe progi w stosunku do pozycji leżącej. Z kolei Mack i wsp. (2001) stwierdzili podwyższony próg temperatury wewnętrznej dla pocenia się podczas ćwiczeń w połączeniu z zastosowaniem LBNP.
Podobne rozbieżności obserwowano podczas badań nad ogrzewaniem biernym. Dodt i wsp. (1995) zastosowali LBNP lub odchylenie głowy o 30° w celu odciążenia baroreceptorów podczas biernego ogrzewania i doszli do wniosku, że odciążenie baroreceptorów może modulować aktywność skórnych nerwów współczulnych (SSNA) i pocenie się u osób o umiarkowanym cieple. Jednakże inni stwierdzili odmienne odpowiedzi (Vissing, Scherrer, i Victor 1994; Wilson, Cui, i Crandall 2005). Vissing i wsp. (1994) nie zaobserwowali zmian w SSNA i poceniu się podczas LBNP. Wilson i wsp. (2005) wykonywali wielokrotne przechylenia głowy o 30° podczas ogrzewania całego ciała. Grupy te stwierdziły, że odciążenie baroreceptorów nie moduluje zarówno pocenia się, jak i SSNA.
Technika komory szyjnej jest przydatna do selektywnej stymulacji baroreceptorów szyjnych. Crandall i wsp. (1996) nie zaobserwowali zmian w CVC podczas odciążania baroreceptorów szyjnych za pomocą impulsów ucisku kołnierza szyjnego o długości 500 ms w każdym cyklu karkowym przez 3 min, niezależnie od warunków termicznych. Jednak w przypadku stymulacji baroreceptorów szyjnych w pętli otwartej (tj. 4 powtarzane 5-sekundowe próby impulsów ucisku lub ssania szyi w odstępie co najmniej 45 s) podczas ogrzewania całego ciała, odciążenie i obciążenie baroreceptorów szyjnych powodowało odpowiednio skórną wazokonstrykcję i wazodylatację (Keller i wsp. 2006). Technika ta pozwala na zwiększenie średniego ciśnienia w zatoce szyjnej do wartości ciśnienia w komorze, osiąganego w każdej próbie.
W celu zmiany ciśnienia tętniczego krwi stosowano środki farmakologiczne. Jak wspomniano wcześniej, Shibasaki i wsp. (2001) zastosowali systemowy wlew nitroprusydku sodu podczas poizometrycznych ćwiczeń chwytnych. Ćwiczenia izometryczne rąk zwiększały zarówno ciśnienie tętnicze, jak i częstość pocenia się. Po niedokrwieniu, ciśnienie krwi i szybkość pocenia się pozostały podwyższone z powodu stymulacji metaborefleksu. Mimo że ciśnienie krwi zostało przywrócone do poziomu sprzed wysiłku przez systemową infuzję nitroprusydku sodu, częstość pocenia się nie zmieniła się, co sugeruje, że wzrost ciśnienia krwi towarzyszący stymulacji metaboreceptorów podczas powysiłkowego niedokrwienia (tj. rozładowanie baroreceptorów) nie jest mechanizmem, za pomocą którego częstość pocenia się jest zwiększona podczas ćwiczeń izometrycznych. Podobnie Wilson i wsp. (2001) stosowali bolus i infuzje o stałym natężeniu środków farmakologicznych (nitroprusydek i fenylefryna) w celu ostrego i przewlekłego upośledzenia czynności receptorów metaboreceptorowych podczas niedokrwienia powysiłkowego (tj. rozładowania baroreceptorów), baroreceptorów, odpowiednio, u normotermicznych i poddanych stresowi cieplnemu ludzi. Pomimo zmian ciśnienia krwi, ani SSNA, ani tempo pocenia się nie ulegały istotnym zmianom. Farmakologicznie indukowane obniżenie ciśnienia krwi może powodować większe rozładowanie baroreceptorów tętniczych w porównaniu z baroreceptorami krążeniowo-oddechowymi, a zatem stymulacja baroreceptorów tętniczych może nie przyczyniać się do modulacji szybkości wydzielania potu. Ponieważ krążenie skórne jest pod kontrolą baroreceptorów, skórne reakcje naczyniowe są modulowane przez obciążenie/nieobciążenie baroreceptorów. Chociaż nadal pozostaje to niejasne, okazuje się, że barorefleksy nie są w stanie modulować pocenia się.
Regulacja płynów ustrojowych – stan nawodnienia i osmolalność osocza
Dryf sercowo-naczyniowy (utrzymanie rzutu serca poprzez wzrost częstości skurczów serca pomimo spadku objętości wyrzutowej) występuje po 10 min umiarkowanego lub intensywnego wysiłku (Coyle i Gonzalez-Alonso 2001). Wielkość dryfu sercowo-naczyniowego jest większa w środowisku gorącym w porównaniu do środowiska termicznie neutralnego (Lafrenz i wsp. 2008). Jednakże, dryf układu krążenia podczas długotrwałego wysiłku może być przywrócony przez wymianę płynów ustrojowych (Hamilton et al. 1991). I odwrotnie, długotrwały wysiłek fizyczny może zmniejszyć rzut serca z powodu utraty wody w organizmie (pocenie się) i redystrybucji objętości krwi (rozszerzenie naczyń skórnych). Dill i wsp. (1933) zaobserwowali, że kiedy człowiek i pies przeszli 32 km w gorącym środowisku z poborem wody ad libitum, pies utrzymał swoją masę ciała, ale człowiek stracił -3 kg masy ciała. Ponieważ człowiek tracił zarówno sól, jak i wodę poprzez pocenie się, pił tylko tyle wody, aby utrzymać stałą osmolalność płynu zewnątrzkomórkowego, podczas gdy pies pił tyle wody, aby utrzymać masę ciała, ponieważ tracił tylko wodę poprzez parowanie oddechowe (tj. dyszenie). U ludzi, długotrwały wysiłek fizyczny w gorącym środowisku wywołuje deficyt wody z powodu obfitego pocenia się, a ten deficyt płynów obniża zarówno objętość wewnątrzkomórkową jak i zewnątrzkomórkową prowadząc do hiperosmolalności osocza i hipowolemii.
Osmolalność osocza jest ściśle regulowana w niewielkim zakresie, przy czym bardzo małe wzrosty wywołują reakcje fizjologiczne, takie jak wydzielanie wazopresyny i zwiększone pragnienie. Fortney i wsp. (1984) przeprowadzili próby wysiłkowe zarówno w warunkach izoosmotycznych jak i hiperosmotycznych z zachowaną objętością osocza. Podczas hiperosmotycznych prób wysiłkowych, progi temperatury wewnętrznej zarówno dla pocenia się jak i przepływu krwi przez przedramię były podwyższone w stosunku do odpowiedzi podczas ćwiczeń w warunkach izoosmotycznych. Zwiększona osmolalność osocza nie miała wpływu na nachylenie zboczy dla pocenia się i skórnej wazodylatacji jako funkcji podwyższenia temperatury wewnętrznej. Wyniki te zostały potwierdzone podczas pasywnego ogrzewania (poprzez zanurzenie podudzi w ciepłej wodzie), w którym badani otrzymywali wlew 0,9% (izoosmotyczny) lub 3% (hiperosmotyczny) soli fizjologicznej (Takamata i wsp. 1995, 1997). W badaniu uzupełniającym Shibasaki i wsp. (2009) stwierdzili, że opóźnienie wzrostu skórnego przepływu krwi wynikało przede wszystkim z opóźnienia początku skórnej aktywnej aktywności wazodylatacyjnej, w przeciwieństwie do zwiększonej aktywności wazokonstrykcyjnej. Ponadto wykazali, że hiperosmolalność osocza nie moduluje skórnego układu wazokonstrykcyjnego podczas stresu zimna. W badaniach tych zmieniono osmolalność osocza bez zmniejszenia jego objętości. Ito i wsp. (2005) oraz Lynn i wsp. (2012) wykazali addytywny wpływ hiperosmolalności osocza i rozładowania baroreceptorów na CVC, ale nie na pocenie się.
Tak więc zwiększona osmolalność osocza, niezależna od jego objętości, upośledza układ sudomotoryczny i aktywny układ naczyniorozszerzający, natomiast nie zmienia skórnego układu wazokonstrykcyjnego. Upośledzenie skórnego układu naczyniorozszerzającego spowodowane hiperosmolalnością jest modulowane przez stymulację baroreceptorów, podczas gdy odpowiedź potowa pozostaje bez zmian.
Hipowolemia, w połączeniu ze wzrostem szybkości wydzielania potu i redystrybucją krwi do naczyń skórnych w celu termoregulacji, powoduje obniżenie ciśnienia napełniania serca. Skórny przepływ krwi wzrasta proporcjonalnie do wzrostu temperatury wewnętrznej, ale wzrost CVC jest znacznie osłabiony (Brengelmann i wsp. 1977; Fortney i wsp. 1981a; Kellogg i wsp. 1993; Nadel, Fortney i Wenger 1980; Nose i wsp. 1990), gdy temperatura wewnętrzna osiąga -38°C (ryc. 3.2). Tłumienie wzrostu CVC po znacznym podwyższeniu temperatury wewnętrznej jest mechanizmem sprzężenia zwrotnego, mającym na celu utrzymanie ciśnienia napełniania serca. Zarówno infuzja soli fizjologicznej, jak i zastosowanie oddychania podciśnieniowego po podwyższeniu temperatury wewnętrznej (-0,5°C) niweczą tłumienie przepływu krwi przez przedramię i CVC powyżej temperatury wewnętrznej -38°C (Nagashima i wsp. 1998; Nose i wsp. 1990). Obserwacje te, w połączeniu z ustaleniem, że tłumienie wzrostu CVC jest kontrolowane przez aktywny układ naczyniorozszerzający (Kellogg i wsp. 1993), sugerują, że hamowanie skórnych odpowiedzi naczyniorozszerzających podczas pasywnego ogrzewania i wysiłku fizycznego może utrzymywać ośrodkowe ciśnienie żylne, być może poprzez wspomniane mechanizmy odruchu barowego u osób z hipowolemią. Kamijo i wsp. (2011) sklasyfikowali SSNA na dwie składowe (zsynchronizowaną z cyklem pracy serca lub bez niego) i zasugerowali, że hipowolemiczna supresja skórnej wazodylatacji wynika z redukcji składowej SSNA zsynchronizowanej z cyklem pracy serca. Składowa SSNA bez synchronizacji z cyklem serca była związana z odpowiedzią na pocenie się i w tym badaniu nie ulegała wpływowi hipowolemii. Hipowolemia wywołana przez leki moczopędne (tj. bez zmiany osmolalności osocza) zmniejszała zarówno szczyt skórnej wazodylatacji, jak i nachylenie zależności między zmianą temperatury wewnętrznej a zmianą skórnej wazodylatacji (termowrażliwość). Leki te przesuwają również próg temperatury wewnętrznej dla wazodylatacji (Fortney i wsp. 198la,b; Kamijo i wsp. 2005; Nadel, Fortney i Wenger 1980), ale nie mają wpływu na kontrolę pocenia się (Fortney i wsp. 1981b; Kamijo i wsp. 2005, 2011).
Płyn ustrojowy jest regulowany przez dwa systemy: regulację objętości i osmoregulację osocza, które nie są zaburzone we wczesnej fazie wysiłku. Długotrwały wysiłek fizyczny wywołuje jednak obfite pocenie się i/lub zmianę objętości krwi, co prowadzi do odwodnienia (hiperosmolalność hipowolemiczna) i zmniejsza termoregulacyjną wazodylatację naczyń skórnych i pocenie się. Zwiększona osmolalność osocza upośledza zarówno wazodylatację skórną, jak i odpowiedź na pocenie się, natomiast zmniejszona objętość osocza upośledza jedynie wazodylatację skórną poprzez mechanizmy odruchu barycznego, ale nie pocenie się.
Zaburzenia pocenia się i przepływu krwi przez skórę
Wewnętrzna temperatura ciała może być utrzymywana w wąskim zakresie, jeśli termoregulacyjne odprowadzanie ciepła jest w pełni sprawne podczas wysiłku (rysunek 3.1). Jeśli jednak ciepło wytworzone podczas wysiłku nie zostanie uwolnione ze skóry, temperatura wewnętrzna natychmiast osiągnie górną bezpieczną granicę (Kenney i Johnson 1992). Niektóre choroby, jak również urazy ciała mogą mieć szkodliwy wpływ na termoregulację.
Choroby, w tym stwardnienie rozsiane (SM) i cukrzyca (DM), mogą zmieniać szlaki neuronalne odpowiednio w ośrodkowym układzie nerwowym i obwodowym układzie nerwowym, prowadząc do upośledzenia pocenia się i skórnego przepływu krwi. Urazy fizyczne mogą powodować ośrodkowe (uszkodzenie rdzenia kręgowego [SCI]) i obwodowe (oparzenia) zaburzenia kontroli pocenia się i skórnego przepływu krwi.
Stwardnienie rozsiane
SM jest niepełnosprawnym postępującym zaburzeniem neurologicznym, dotykającym ponad 2,3 mln osób na całym świecie (National Multiple Sclerosis Society 2014). Patofizjologia SM skutkuje demielinizacją i ostatecznie utratą aksonów oraz dezorganizacją prawidłowej architektury tkanek w obrębie OUN w wyniku autoimmunologicznych reakcji na uraz (Frohman, Racke, i Raine 2006). Demielinizacja wiąże się z odpowiednimi zmianami w fizjologii aksonów, w tym z utratą właściwości saltacyjnych przewodzenia elektrycznego, zmniejszeniem prędkości przewodzenia i predyspozycją do bloku przewodzenia. U osób z SM powszechnie obserwuje się zaburzenia funkcji autonomicznych w zakresie układu termoregulacji (Haensch i Jorg 2006). U większości osób z SM dochodzi do przejściowego i przejściowego zaostrzenia objawów klinicznych i neurologicznych (zjawisko Uhthoffa) w odpowiedzi na szereg czynników, z których najważniejsze to podwyższona temperatura otoczenia/rdzenia ciała i wysiłek fizyczny (Uhthoff 1889). Szacuje się, że od 60% do 80% populacji chorych na SM doświadcza przejściowego i przejściowego pogorszenia objawów klinicznych i neurologicznych w wyniku biernej ekspozycji na ciepło, wysiłku fizycznego (wzrost metabolizmu) lub połączenia obu tych czynników (stres cieplny związany z wysiłkiem fizycznym). Zazwyczaj deficyty spowodowane wzrostem temperatury są odwracalne poprzez usunięcie stresorów cieplnych i umożliwienie późniejszego ochłodzenia (Davis et al. 2008).
U osób z SM, oprócz problemów z przewodnictwem nerwowym związanych z temperaturą, może dochodzić do upośledzenia neuronalnej kontroli funkcji autonomicznych (Huitinga i wsp. 2001). Obszary współczulnego układu nerwowego, które są odpowiedzialne za kontrolę funkcji regulacyjnych, są podatne na patologię związaną z chorobą u osób z SM (Andersen i Nordenbo 1997). Zmiany wpływające na przewodnictwo w OUN u osób z SM upośledzają termoregulacyjne odpowiedzi efektorowe gruczołów potowych (Cartlidge 1972; Noronha, Vas i Aziz 1968; Vas 1969). Nieprawidłowe regiony pocenia się można zidentyfikować za pomocą wywołanych przez pot zmian koloru proszku chinizarynowego umieszczonego na skórze osób po ekspozycji na stres cieplny (Fealey i Sato 2008; Kuno 1956). Interwencje farmakologiczne, takie jak wstrzyknięcia śródskórne, jonoforeza i mikrodializa śródskórna, mogą ocenić funkcję ekrynowych gruczołów potowych, a także naczyń skórnych niezależnie od OUN (Davis i in. 2005). Zmniejszenie funkcji potu zostało określone ilościowo u osób z SM i wynika raczej ze zmniejszonego wydzielania potu przez gruczoł niż ze zmniejszonej rekrutacji gruczołów potowych (Davis i wsp. 2005). Davis i wsp. (2010) udokumentowali zmniejszone reakcje pocenia się u osób z MS podczas pośredniego ogrzewania całego ciała (zwiększającego temperaturę rdzenia o -1°C) przy użyciu kombinezonów przepuszczających wodę. Zaobserwowane zmiany w poceniu się w tych obszarach wynikały wyłącznie z odpowiedzi pośredniczonych przez neurony, a nie z czynników związanych z miejscowym ogrzewaniem, ponieważ obszary, w których oceniano pocenie się, nie miały kontaktu z kombinezonem z membraną wodną używanym do ogrzewania.
tematy. Aby odnieść się do możliwości, że te obserwowane w MS spadki funkcji potu wynikają z odtrenowania lub dezadaptacji, Davis i wsp. (2005) szkolili osoby z MS za pomocą ćwiczeń aerobowych przez 15 tygodni. U zdrowych osób podobny trening poprawia wydzielanie potu na gruczoł. Mimo 15 tygodni treningu u osób z SM nie poprawiła się ani rekrutacja gruczołów potowych, ani wydzielanie potu na gruczoł. Adaptacyjne reakcje termoregulacyjne po treningu wysiłkowym, typowo obserwowane u osób zdrowych, nie występują u osób z MS, co sugeruje upośledzenie kontroli funkcji sudomotorycznych przez OUN u osób z MS. Podsumowując, jest prawdopodobne, że upośledzone reakcje pocenia się mogły być spowodowane upośledzeniem neuronalnej kontroli szlaków sudomotorycznych i/lub zmianami wywołanymi przez neurony w ekrynowych gruczołach potowych (Davis et al. 2010). Co ciekawe, u osób z MS zaobserwowano większy wzrost skórnej wazodylatacji w odpowiedzi na ogrzewanie całego ciała w porównaniu ze zdrowymi osobami z grupy kontrolnej, co sugeruje, że neuronalna kontrola skórnego przepływu krwi jest nienaruszona i może kompensować upośledzenie pocenia się w celu odpowiedniego odprowadzenia ciepła (Davis i wsp. 2010).
Cukrzyca
DM jest chorobą metaboliczną, której objawem jest niemożność kontrolowania stężenia glukozy we krwi, prowadząca do hiperglikemii. Według danych Światowej Organizacji Zdrowia na cukrzycę choruje 347 milionów ludzi na całym świecie (World Health Organization 2014). Dwie najczęstsze klasyfikacje cukrzycy to cukrzyca typu 1 (insulinozależna DM) i typu 2 (nieinsulinozależna DM). Typ 1 (TIDM) jest spowodowany niedoborem produkcji insuliny wywołanym autoimmunologicznym zniszczeniem produkujących insulinę komórek ß w obrębie trzustki, co prowadzi do niezdolności komórek do wychwytywania glukozy. Typ 2 (T2DM) jest wynikiem upośledzonej sygnalizacji i działania insuliny przez komórki, co prowadzi do insulinooporności. Z czasem niekontrolowana hiperglikemia może prowadzić do poważnych, długoterminowych powikłań zdrowotnych, ale nie tylko: chorób układu sercowo-naczyniowego, uszkodzenia nerwów i nerek.
Dwa charakterystyczne powikłania cukrzycy, uszkodzenie mikronaczyń i obwodowa neuropatia autonomiczna, mogą mieć potencjalnie głęboki wpływ na skórne rozszerzenie naczyń i pocenie się. Ze względu na możliwość uszkodzenia obwodowych mikronaczyń i nerwów, skórne odpowiedzi wazodylatacyjne były badane podczas bezpośredniego, miejscowego ogrzewania skóry. Osoby z TIDM (Khan i wsp. 2000; Stansberry i wsp. 1997; Wilson, Jennings i Belch 1992) oraz T2DM (Fredriksson i wsp. 2010; Schmiedel, Schroeter i Harvey 2007; Stansberry i wsp. 1997; Strom i wsp. 2010) wykazują zmniejszenie skórnej wazodylatacji podczas miejscowego ogrzewania w porównaniu ze zdrowymi osobami z grupy kontrolnej. U osób z T2DM zaobserwowano również mniejszą bezwzględną maksymalną wazodylatację podczas ogrzewania miejscowego w porównaniu ze zdrowymi osobami z grupy kontrolnej (Sokolnicki i wsp. 2007; Wick i wsp. 2006).
Odruchowe skórne reakcje wazodylatacyjne są również osłabione podczas pośredniego ogrzewania całego ciała (wzrost temperatury rdzenia -1°C) z użyciem kombinezonu wypełnionego wodą u osób z T2DM (Sokolnicki i wsp. 2009). Oprócz niższego skórnego przepływu krwi ocenianego w miejscach, które nie były bezpośrednio narażone na bodziec grzewczy, temperatura rdzenia, przy której obserwuje się wzrost skórnej wazodylatacji, jest wyższa podczas ogrzewania całego ciała, co sugeruje opóźniony początek aktywnej wazodylatacji (Wick i wsp. 2006). Co ciekawe, odruchowe skórne odpowiedzi wazokonstrykcyjne na szybkie ogrzewanie całego ciała chłodzenia są zachowane u osób z T2DM (Strom i wsp. 2011), co sugeruje, że choroba ta wpływa jedynie na skórną wazodylatację.
Zmniejszona odpowiedź wazodylatacyjna obserwowana u osób z cukrzycą podczas ogrzewania miejscowego i całego ciała może być częściowo spowodowana zmianami w uwalnianiu NO i/lub upośledzoną reaktywnością naczyń na NO. Pomimo obserwowanych różnic w maksymalnej wazodylatacji u osób z T2DM, mechanizmy działania miejscowego nerwu czuciowego (Strom i wsp. 2010) oraz względny udział NO (Sokolnicki i wsp. 2007) w dwufazowej odpowiedzi wazodylatacyjnej na miejscowe ogrzewanie skóry były podobne u osób z T2DM i zdrowych osób z grupy kontrolnej. Obwodowe interwencje farmakologiczne (tj. jonoforeza i mikrodializa śródskórna) były również wykorzystywane do dalszej oceny odpowiedzi skórnych naczyń krwionośnych u osób z cukrzycą. Zależna od śródbłonka skórna wazodylatacja wywołana podaniem acetylocholiny (lub agonistów, takich jak pilokarpina) jest zmniejszona zarówno w TlDM (Gomes, Matheus i Tibirica 2008; Katz i wsp. 2001; Khan i wsp. 2000), jak i T2DM (Arora i wsp. 1998; Beer i wsp. 2008; Berghoff i wsp. 2006; Schmiedel, Schroeter i Harvey 2007). Niezależna od śródbłonka skórna wazodylatacja wydaje się również upośledzona po jonoforetycznym podaniu nitroprusydku sodu, donora NO, u osób z TlDM (Katz i wsp. 2001; Khan i wsp. 2000) i T2DM (Arora i wsp. 1998; Beer i wsp. 2008; Schmiedel, Schroeter i Harvey 2007). W sumie wyniki te sugerują, że osłabiona reaktywność wazodylatacyjna u osób z cukrzycą obserwowana podczas miejscowego ogrzewania i ogrzewania całego ciała może być częściowo spowodowana zmienioną reaktywnością NO w naczyniach skórnych w wyniku uszkodzenia mikronaczyń wywołanego cukrzycą.
Osoby z T lDM (Fealey, Low, i Thomas 1989) i T2DM (Fealey, Low, i Thomas 1989; Petrofsky 2012) wykazują zmniejszoną potliwość podczas ekspozycji całego ciała na pasywny stres cieplny. Zmniejszoną reakcję na pocenie zaobserwowano również u osób z T2DM podczas biernej ekspozycji nawet na niską temperaturę otaczającego powietrza (Petrofsky i Lee 2005). Upośledzenie reakcji potowych obserwowano również po jonoforezie acetylocholiny u osób z TlDM (Hoeldtke i wsp. 2001; Kennedy i Navarro 1989; Kennedy i wsp. 1984; Kihara, Opfer-Gehrking, i Low 1993) oraz T2DM (Kihara, Opfer-Gehrking, i Low 1993). Większy stopień obwodowej neuropatii autonomicznej był związany z większym upośledzeniem pocenia się u osób z cukrzycą (Fealey, Low i Thomas 1989). Upośledzenie reakcji pocenia się jest prawdopodobnie spowodowane neuropatią autonomiczną prowadzącą do zmniejszenia liczby aktywnych gruczołów potowych i zmniejszonego parowania potu.
Niewiele badań dotyczyło funkcji potu u osób z cukrzycą podczas wysiłku fizycznego. Opisane wcześniej wyniki sugerowałyby, że funkcja termoregulacyjna będzie prawdopodobnie upośledzona podczas wysiłku fizycznego u osób z cukrzycą. Jednak Stapleton i wsp. (Stapleton i wsp. 2013) nie wykazali upośledzenia zdolności do odprowadzania ciepła u zwykle aktywnych osób z TIDM ćwiczących w bezpośrednim kalorymetrze całego ciała. Skórny przepływ krwi i reakcje pocenia się były porównywalne ze zdrowymi osobami z grupy kontrolnej podczas lekkiego lub umiarkowanego wysiłku fizycznego. Jednak osłabiona potliwość u osób z TIDM ujawnia się podczas ćwiczeń o większej intensywności (Carter i wsp. 2014). Starsze osoby z T2DM (> 55. roku życia) również wykazywały upośledzoną utratę ciepła podczas umiarkowanego wysiłku fizycznego w bezpośrednim kalorymetrze całego ciała (Kenny i wsp. 2013). Wyniki te sugerują, że upośledzenie termoregulacji może stają się bardziej problematyczne u osób z cukrzycą podczas większych obciążeń termicznych (podwyższona temperatura i wilgotność) oraz niższego poziomu sprawności fizycznej, a także nasilenia powikłań i progresji cukrzycy, w tym neuropatii i złej kontroli glikemii (Stapleton i wsp. 2013).
Uszkodzenie rdzenia kręgowego
SCI to uszkodzenie rdzenia kręgowego powodujące czasowe lub trwałe zmiany funkcji nerwowych. Uszkodzenie jest zwykle wynikiem urazu rdzenia kręgowego, który powoduje złamania i ucisk kręgów, co prowadzi do zmiażdżenia lub rozerwania aksonów w rdzeniu kręgowym przez fragmenty kości. W wyniku SCI może dojść do uszkodzenia kilku, wielu lub prawie wszystkich aksonów w uszkodzonym obszarze, co prowadzi do często wyniszczających deficytów neurologicznych i niepełnosprawności poniżej miejsca urazu. Urazy kręgosłupa szyjnego zazwyczaj powodują deficyty neurologiczne i niepełnosprawność zarówno w kończynach górnych, jak i dolnych (tetraplegia). Urazy na wysokości lub poniżej piersiowego odcinka rdzenia kręgowego zwykle obejmują tylko kończyny dolne (paraplegia). W związku z tym osoby z paraplegią mają większe aferentne i eferentne przetwarzanie neuronalne w porównaniu z osobami tetraplegicznymi. Jak można się spodziewać, SCI prowadzi do zaburzeń funkcji fizjologicznych, w tym termoregulacji. Wielkość dysfunkcji termoregulacyjnej jest proporcjonalna do poziomu SCI, przy czym tetraplegicy wykazują większe upośledzenie w porównaniu z paraplegikami.
Upośledzenie neuronalnej kontroli skórnej wazodylatacji obserwuje się u osób z SCI zarówno podczas biernego ogrzewania, jak i wysiłku fizycznego. Nie zaobserwowano zmian w przepływie krwi przez przedramię, używanym jako wskaźnik skórnego przepływu krwi, u osób z paraplegią podczas biernego ogrzewania kończyn dolnych (tj. skóry niewrażliwej) (Freund i wsp. 1984). Tylko niewielkie zmiany w przepływie krwi w przedramieniu stwierdzono podczas pośredniego ogrzewania całego ciała (zarówno skóry wrażliwej, jak i niewrażliwej) (wzrost temperatury rdzenia) przy użyciu kombinezonów wypełnionych wodą. Reakcje rozszerzania naczyń skórnych są również upośledzone w skórze położonej poniżej poziomu SCI podczas bezpośredniego miejscowego ogrzewania skóry (Nicotra, Asahina i Mathias 2004). Podczas ćwiczeń fizycznych, skórne rozszerzenie naczyń krwionośnych wzrastało około czterokrotnie u osób pełnosprawnych, podczas gdy u paraplegików z SCI nie zaobserwowano żadnych zmian podczas wykonywania ćwiczeń z użyciem korby na ramieniu (Theisen i in. 2000). Podobnie, paraplegicy z SCI doświadczali znacznie niższej CVC niż osoby sprawne podczas ćwiczenia korby ramienia przy 50% maksymalnej mocy wyjściowej (Theisen i wsp. 2001). Upośledzenie wazodylatacji skórnej poniżej poziomu SCI podczas stresu termicznego jest zgodne z zaburzeniem współczulnej kontroli wazomotorycznej naczyń skórnych (Wallin i Stjernberg 1984).
Zmniejszone pocenie się lub całkowity brak reakcji pocenia się są powszechnie obserwowane w nieczułej skórze osób z SCI zarówno podczas biernego ogrzewania (Freund i wsp. 1984; Huckaba i wsp. 1976; Tann i wsp. 1978; Totel 1974; Totel i wsp. 1971), jak i ćwiczeń fizycznych (Castle i wsp. 2013; Gass, Gass i Pitetti 2002; Price i Campbell 1997, 1999a,b). Podczas gdy te upośledzenia pocenia się są prawdopodobnie spowodowane przerwaniem neuronów sudomotorycznych kontrolujących funkcję gruczołów potowych, zaburzenie szlaków neuronalnych w SCI może również prowadzić do zmniejszenia aferentnego sprzężenia zwrotnego do podwzgórza, które może stymulować pocenie się podczas ćwiczeń u osób sprawnych, jak opisano wcześniej. Ponadto, zmienione unerwienie sudomotoryczne gruczołów potowych w SCI może prowadzić do zmian obwodowych w samym gruczole. Gruczoły potowe poniżej uszkodzenia są mniej wrażliwe na aktywację cholinergiczną (obwodowe podawanie acetylocholiny poprzez jonoforezę) (Yaggie, Niemi, i Buono 2002).
Ze względu na upośledzenie skórnej wazodylatacji i pocenia się, osoby z SCI zwykle wykazują większy wzrost temperatury skóry podczas ekspozycji na ciepło na skórze niewrażliwej w porównaniu ze skórą wrażliwą (Price 2006). Jest to bardziej prawdopodobne u tetraplegików, ponieważ mają oni większą powierzchnię skóry pozbawionej czucia, co prowadzi do większego wzrostu temperatury skóry, a następnie temperatury rdzenia podczas ekspozycji na ciepło i wysiłku fizycznego w porównaniu z paraplegikami. Aby zrekompensować utratę mechanizmów termoregulacyjnych w niewrażliwej skórze poniżej poziomu uszkodzenia rdzenia, obserwuje się poprawę funkcji potu w skórze wrażliwej powyżej uszkodzenia rdzenia zarówno u tetraplegików, jak i paraplegików (Huckaba i wsp. 1976; Petrofsky 1992; Price i Campbell 1997). W związku z tym paraplegicy wykazują podobne reakcje na temperaturę rdzenia podczas ćwiczeń w chłodnym lub neutralnym termicznie środowisku w porównaniu z osobami sprawnymi, pomimo upośledzenia neuronalnej kontroli skórnego rozszerzenia naczyń i pocenia się (Dawson, Bridle i Lockwood 1994; Hopman, Oeseburg i Binkhorst 1993; Price i Campbell 1999a,b). Upośledzenie funkcji terapeutyczno-regulacyjnych staje się jednak bardziej problematyczne podczas ćwiczeń w cieplejszym środowisku (Price 2006).
Oparzenia i przeszczepy skóry
Każdego roku w Stanach Zjednoczonych oparzeniom ulega 1,4 miliona osób. W przypadku ciężkich oparzeń skóry, zazwyczaj wycina się większość całej warstwy skóry właściwej, która zawiera naczynia krwionośne i gruczoły potowe niezbędne do termoregulacji. Wycięty obszar jest następnie pokrywany skórą dawcy (przeszczepem skóry) pobraną z nieuszkodzonych okolic ciała. Około 90% przeszczepów skóry to przeszczepy typu split-thickness, w których cały naskórek i część skóry właściwej są pobierane z miejsca dawcy i przeszczepiane w miejsce zranienia.
W połączeniu z brakiem gruczołów potowych przeszczepione obszary nie będą w stanie odprowadzać ciepła bez reinerwacji neuronalnej i funkcjonalnej rewaskularyzacji. Osoby z zagojonymi oparzeniami powyżej 40% powierzchni ciała mają wyższą temperaturę rdzenia podczas wyzwania termicznego w porównaniu z osobami nieoparzonymi (Ben-Simchon i wsp. 1981; McGibbon i wsp. 1973; Roskind i wsp. 1978; Shapiro i wsp. 1982). Badano reakcje naczyniowe skóry zarówno przeszczepionej, jak i przyległej, nieuszkodzonej skóry (Davis et al. 2007b). Davis i wsp. stwierdzili, że skórna wazodylatacja w miejscu przeszczepu była znacznie osłabiona podczas pośredniego ogrzewania całego ciała (tj. ogrzewania pacjenta, ale nie obszaru, w którym ocenia się przepływ krwi przez skórę), a deficyt ten utrzymywał się do ponad 4 lat po zabiegu przeszczepu (Davis i wsp. 2007b, 2009). Co ciekawe, skórne zwężenie naczyń krwionośnych oceniane podczas pośredniego chłodzenia całego ciała (tj. chłodzenia pacjenta, ale nie obszaru, w którym ocenia się przepływ krwi przez skórę) było podobne w miejscach przeszczepionych i kontrolnych. Ta prawidłowa zdolność wazokonstrykcji w przeszczepionej skórze wskazuje na obecność funkcjonalnych nerwów adrenergicznych, funkcjonalnych receptorów m-adrenergicznych i związanych z nimi receptorów ko-transmiterowych w naczyniach skórnych oraz prawidłowych odpowiedzi mięśni gładkich na stymulację neuronalną (Davis i wsp. 2007b, 2009). Łącznie, przeszczepiona skóra wykazuje prawidłową reinnernację skórnej kończyny wazokonstrykcyjnej, ale upośledzona reinnerwacja aktywnej kończyny wazodylatacyjnej.
Przeszczep skóry nie miał negatywnego wpływu na odpowiedzi skórnych naczyń krwionośnych na utrzymujące się miejscowe ogrzewanie całej kończyny, chociaż odpowiedzi te były skrajnie różne u różnych osób (Freund i wsp. 1981). Davis i wsp. (2007b, 2009) monitorowali przepływ krwi w skórze zarówno przeszczepionej, jak i przylegającej, nieuszkodzonej skórze w warunkach normotermicznych (tj. temperatura miejscowa 34°C) oraz podczas 30-minutowego ogrzewania miejscowego w temperaturze 42°C. Wielkość skórnego rozszerzenia naczyń krwionośnych w odpowiedzi na ten protokół ogrzewania miejscowego była znacząco mniejsza w miejscach przeszczepu w porównaniu z sąsiadującymi miejscami kontrolnymi, niezależnie od stopnia dojrzałości przeszczepu (Davis et al. 2007b, 2009). Mimo że indukowana miejscowym ogrzewaniem wazodylatacja jest znacznie upośledzona w przeszczepionej skórze, wielkość rozszerzenia naczyń w odpowiedzi na ten bodziec była znacznie większa niż podczas ogrzewania całego ciała, gdy oceniane miejsca nie były bezpośrednio narażone na bodziec grzewczy. Tak więc przeszczepiona skóra zachowuje, w większym stopniu, zdolność do rozszerzania się pod wpływem bodźca ogrzewania miejscowego w porównaniu z bodźcem ogrzewania całego ciała. Przyczyną tak dużej różnicy w rozszerzaniu naczyń skórnych w przeszczepionej tkance pomiędzy tymi bodźcami grzewczymi są prawdopodobnie różne mechanizmy, dzięki którym skóra rozszerza się po wzroście temperatury miejscowej w porównaniu z temperaturą rdzenia (Charkoudian 2010).
Zmniejszona odpowiedź wazodylatacyjna przeszczepionej skóry podczas ogrzewania miejscowego i całego ciała może być częściowo spowodowana zmianami w uwalnianiu NO i/lub upośledzoną reaktywnością naczyń na NO. Davis i wsp. (2007a, 2009) starali się ustalić, czy przeszczep skóry upośledza skórną wazodylatację poprzez perfuzję acetylocholiny (zależną od śródbłonka) i nitroprusydku sodu (niezależną od śródbłonka) przez śródskórne sondy mikrodializacyjne umieszczone w przeszczepionej i przyległej, nieuszkodzonej skórze. Maksymalny wzrost skórnego przepływu krwi spowodowany podaniem acetylocholiny był istotnie niższy w miejscach szczepionych, niezależnie od stopnia dojrzałości przeszczepu (Davis i wsp. 2007a, 2009). Efektywne stężenie leku powodujące 50% maksymalnej odpowiedzi wazodylatacyjnej (ECSO) na krzywej dawka-odpowiedź z miejsc szczepionych było znacząco większe w porównaniu z miejscami nieuszkodzonymi, co wskazuje na przesunięcie krzywej w prawo, reprezentujące zmniejszoną wrażliwość odpowiedzi wazodylatacyjnej na acetylocholinę (Davis i wsp. 2007a, 2009). I odwrotnie, maksymalna reaktywność skórnych naczyń na nitroprusydek sodu, jak również EC50 krzywych dawka-odpowiedź, nie różniły się między miejscami nieuszkodzonymi i przeszczepionymi (Davis i wsp. 2007a). Biorąc pod uwagę wyniki tych badań mikrodializy, osłabiona reaktywność naczyń podczas miejscowego ogrzewania i ogrzewania całego ciała w przeszczepionej skórze może być częściowo spowodowana zmienionym uwalnianiem NO ze źródeł śródbłonkowych (Kellogg, Johnson i Kosiba 1989; Kellogg i wsp. 1998; Shastry i wsp. 1998, 2000). Jednakże jest mało prawdopodobne, aby samo zmniejszone uwalnianie NO mogło w całości odpowiadać za spadek skórnej wazodylatacji w skórze przeszczepionej podczas stresu cieplnego całego ciała.
Brak pocenia się w przeszczepach o rozdwojonej grubości był już wcześniej opisywany (Conway 1939; McGibbon et al. 1973; McGregor 1950; Ponten 1960). Uważano, że zgłoszony brak pocenia się w przeszczepach skóry o rozdwojonej grubości wynika z połączenia pierwotnego urazu uszkadzającego gruczoły potowe w miejscu biorcy oraz braku w pobranej skórze głębszych struktur skórnych, w tym cewek wydzielniczych gruczołów potowych (Ablove i Howell 1997; Ponten 1960). Davis i współpracownicy (2007b, 2009) oceniali kierowane centralnie reakcje sudomotoryczne w przeszczepionej skórze podczas całego ciała i wykazały minimalne pocenie się lub jego brak w przeszczepionej skórze 5-9 miesięcy po operacji przeszczepu w porównaniu z sąsiadującą nieuszkodzoną skórą. Tempo wydzielania potu było znacząco zmniejszone w miejscu przeszczepu, a wielkość tego osłabienia nie różniła się w porównaniu z dojrzałością przeszczepu. Dane te potwierdzają hipotezę, że reakcje pocenia się na stres cieplny całego ciała pozostają zaburzone w miarę dojrzewania przeszczepu.
Nie wiadomo, czy zmniejszone reakcje pocenia się wynikały z braku funkcjonalnych gruczołów potowych, czy z zaburzonego unerwienia gruczołów potowych. Aby odpowiedzieć na to pytanie, oceniano reakcje pocenia się na bodziec obwodowy (egzogenne podawanie acetylocholiny) w sposób zależny od dawki (Shibasaki i Crandall 2001). Szybkość wydzielania potu za pomocą higrometrii pojemnościowej mierzono bezpośrednio nad błonami mikrodializacyjnymi perfundowanymi wzrastającymi dawkami acetylocholiny w skórze przeszczepionej i sąsiadującej z nią nieuszkodzonej (Davis i wsp. 2007a, 2009). Wykazano, że reaktywność na pocenie się jest upośledzona w przeszczepach skóry, prawdopodobnie z powodu zmniejszenia lub braku funkcjonalnych gruczołów potowych w przeszczepionej tkance, oraz że reaktywność na pocenie się wykazuje niewielkie oznaki normalizacji wraz z gojeniem się przeszczepu (Davis i wsp. 2007a, 2009).
Odprowadzanie ciepła ma kluczowe znaczenie dla homeostazy temperatury, szczególnie podczas ekspozycji na wysoką temperaturę otoczenia, podczas wysiłku fizycznego lub kombinacji obu tych czynników. Dynamiczny wysiłek fizyczny, nawet w środowisku termoneutralnym, zwiększa metaboliczną produkcję ciepła, prowadząc natychmiast do podwyższenia temperatury ciała. Znaczenie tych mechanizmów termoregulacyjnych ilustruje obliczenie, że gdyby ciepło nie było uwalniane ze skóry, wewnętrzna temperatura ciała osiągnęłaby granicę krytyczną już po 10 minutach umiarkowanego wysiłku. W niniejszym rozdziale podsumowano szereg czynników modulujących funkcję potu i/lub skórny przepływ krwi, a także upośledzenie funkcji termoregulacyjnych spowodowane stanami chorobowymi (np. stwardnienie rozsiane i DM) oraz urazami (np. uszkodzenie rdzenia kręgowego i oparzenia). Chcielibyśmy podkreślić, że identyfikacja i zrozumienie czynników modyfikujących funkcje termoregulacyjne dostarczyły wiedzy krytycznej dla poprawy bezpieczeństwa i dobrostanu osób zdrowych podczas ekspozycji na ekstremalne temperatury i wysiłek fizyczny. Dalsze badania nad mechanizmami upośledzającymi funkcje termoregulacyjne mogą doprowadzić do opracowania metod i strategii terapeutycznych, tak aby populacje kliniczne mogły bezpiecznie tolerować narażenie na ciepło i wysiłek fizyczny.
Materiał r na warunkach licencji Creative Commons http://creativecommons.org/licenses/by-nc-nd/4.0. Autorzy: Manabu Shibasaki i Scott L. Davis
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny













Więcej
Detoks narkotykowy alkoholowy nikotynowy
Lista 100 substancji biochemicznych toksycznych wśród nich nie tylko tal ale leki trudno wykryć
Liczba Lekarzy i Pielęgniarek