Ostatnia aktualizacja 28 lipca 2022
Powyżej lista kliku badań klinicznych (dla przykładu) zarejestrowanych na przeprowadzenie w Polsce. Dla Ciebie pomocna strona euclinicaltrials.eu
Dlaczego badania kliniczne są potrzebne?
Badanie kliniczne to badanie naukowe z udziałem ludzi, prowadzone w celu oceny skuteczności i bezpieczeństwa nowego leku lub rozszerzenia zakresu stosowania istniejącego leku. Oprócz leków, badania jakościowe mogą również dotyczyć skuteczności i bezpieczeństwa nowych metod leczenia i diagnostyki.
Medycyna staje się nauką ścisłą, w której nie brakuje danych statystycznych. Dawniej lekarz rodzinny znał na pamięć historie wszystkich swoich pacjentów; lekarz mógł mieszkać całe życie w tym samym mieście i znaleźć oraz zapamiętać osobiste podejście do leczenia każdego z nich. Ponadto wybór leków był niewielki: zioła lecznicze, pijawki, rtęć i arszenik.
W tamtym okresie na lekarzach spoczywała mniejsza odpowiedzialność, żeby nie powiedzieć jej brak.
Kiedy medycyna stała się głównym nurtem, pojawiła się potrzeba opracowania przez lekarzy taktyki leczenia naprawdę wolnej od błędów. Pewne leki miały pomagać większości pacjentów w określonych warunkach.
W idealnej sytuacji lekarz powinien stosować tylko te metody zapobiegania, diagnozowania i leczenia, w przypadku których prawdopodobieństwo uzyskania “przypadkowych wyników” jest bardzo małe, ponieważ ich przydatność i skuteczność została udowodniona w wielu prawidłowo przeprowadzonych eksperymentach.
Jest to medycyna oparta na dowodach – jedyne właściwe podejście do tak poważnej sprawy, jaką jest obecnie zdrowie człowieka.
A to właśnie badania kliniczne są podstawą medycyny opartej na dowodach naukowych.
Do połowy XX wieku nie istniały żadne regulacje dotyczące badań nad nowymi lekami. Jak to często bywa, potrzeba było kilku tragedii, aby wszystko uporządkować.
W 1937 roku zmarło 105 dzieci i jedna osoba dorosła, która zażyła “eliksir” składający się z antyseptycznego sulfonamidu i trującego glikolu dietylenowego. Takiego, jakiego używa się w płynach przeciw zamarzaniu. W tamtych czasach firma farmaceutyczna M. E. Massengill nieświadomie użyła go jako rozpuszczalnika, adiuwanta. Nie przeprowadzono badań bezpieczeństwa powstałego w ten sposób “koktajlu” dla ludzi. Kiedy przypomniano sobie o tym i wycofano lek ze sprzedaży, ofiar było już ponad sto.
W 1938 r. Kongres USA uchwalił ustawę wymagającą obowiązkowych badań leków przed wprowadzeniem ich na rynek. Żywności i Leków (FDA), której zadaniem było nadzorowanie tego procesu.
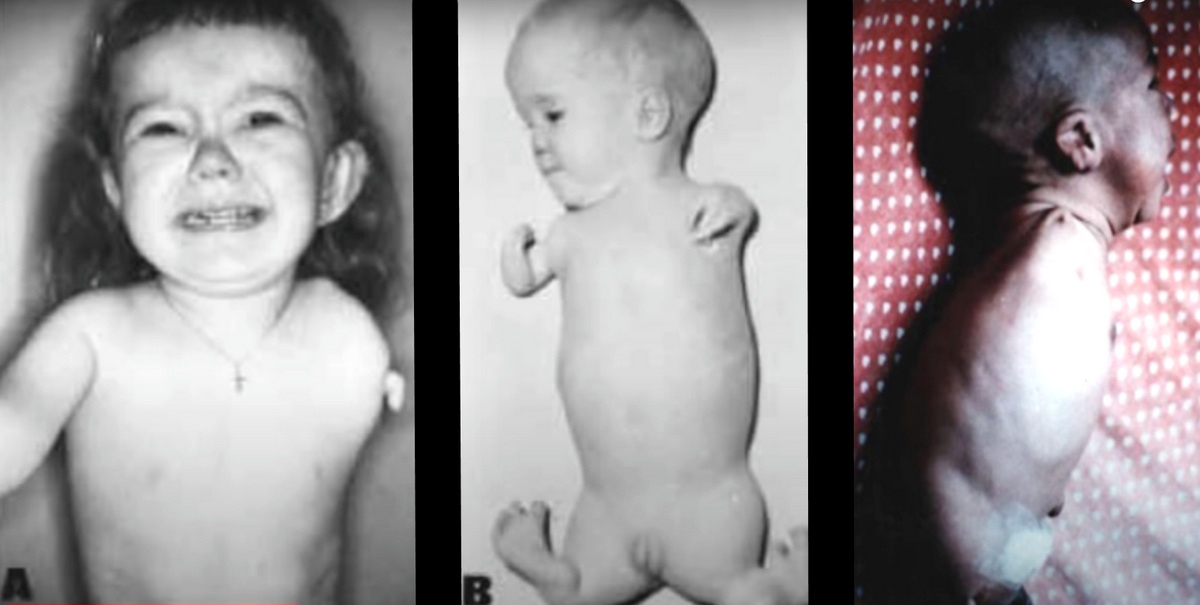
Jeszcze większy skandal wybuchł w związku z talidomidem na przełomie lat 50. i 60. „Środek uspokajający i nasenny”, okazał się doskonałą trucizną dla kobiet w ciąży. Z chwilą jego wprowadzenia na rynek doskonale się sprzedawał, niestety przebadano go tylko na szczurach, co było niewystarczające. U ludzi Talidomid powodował wady rozwojowe płodu. W Europie, Australii i Japonii urodziło się około 10 000 dzieci z wadami rozwojowymi kończyn (malformacjami). Lek został zakazany w większości krajów w 1961 roku.
Od tego czasu leki są bardzo dokładnie sprawdzane przed zarejestrowaniem. Jest to regulowane przez Międzynarodowe Zharmonizowane Trójstronne Wytyczne Dobrej Praktyki Klinicznej. Obowiązują one w USA, UE, Japonii i innych państwach (pełna lista Członków i Obserwatorów tutaj ).
Źródło: clinicaltrials.gov
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny










Więcej
W Polsce brakuje cukru i drożeje? On był jest i będzie tani dla zdrowia. Nie przepłacaj
Likwidowanie ciężkiego bólu bez leków? Już to możliwe
Uważaj z kim się całujesz kogo ssiesz lub kto ciebie liże aby nie skończyło się zarażeniem