
Ostatnia aktualizacja 28 lipca 2022
Kiedy mózg ludzki funkcjonuje prawidłowo jest w stanie codziennie odróżniać dzień od nocy, regulować poziom hormonów po napięcie mięśni, regulować częstość oddychania po treść naszych myśli.
Ale aby mógł prawidłowo funkcjonować potrzebuje snu – sen wpływa na wszystkie funkcje cielesne i poznawcze.
Nie dziwi więc wpływ snu na organizm, ponieważ prowadzi on do istotnych zmian w ogólnej aktywności elektrycznej mózgu. Zmiany sygnału elektrycznego w mózgu (rytm snu i czuwania) są regulowane przez cząsteczki neurohormonalne i ich receptory w organizmie. Neuroprzekaźniki, które kontrolują sen i czuwanie, można wymienić jako “glutaminian, acetylocholinę, histaminę, noradrenalinę i GABA”.
Główne hormony to: melatonina, hormon uwalniający kortykotropinę (CRH), kortyzol, prolaktyna, hormon wzrostu (GH), insulinopodobny czynnik wzrostu (IGF-1, somatomedyna-C), hormon stymulujący pęcherzyki (FSH) i hormon luteinizujący (LH), progesteron, estrogeny, testosteron, katecholaminy, leptyna i neuropeptyd Y″.
Wpływ środków farmakologicznych na cykle snu i czuwania jest realizowany przez następujące cząsteczki i ich receptory: leki hipnotyczne (agoniści GABA A, benzodiazepiny, gabapentyna, tiagabina), leki przeciwdepresyjne o działaniu sedatywnym (trójpierścieniowe leki przeciwdepresyjne, trazadon, mitrazapina), leki przeciwhistaminowe, leki stosowane w leczeniu bezsenności (melatonina i analogi melatoniny), amfetamina (najczęściej stosowana substancja pobudzająca), wydzielanie monoamin (dopamina), nieamfetaminowe środki pobudzające stosowane w leczeniu hipersomnii i narkolepsji (modafinil, bupropion, selegilina, kofeina) oraz inne substancje (alkohol, nikotyna, środki znieczulające).
W stopniu, w jakim potrafimy sobie wyobrazić mechanizmy fizjologiczne wymienionych powyżej podstawowych cząsteczek i regionów, na które oddziałują, możemy docenić wpływ tych substancji na fizjologię snu i zaburzenia snu.
Zdrowa interakcja między okresami czuwania i snu oraz równowaga właściwa dla danego organizmu są niezbędne do utrzymania prawidłowego funkcjonowania fizjologii człowieka, a w szczególności ośrodkowego układu nerwowego (OUN). Sen jest potrzebą fizjologiczną, jest zachowaniem, podczas którego reakcja mózgu na bodźce środowiskowe ulega odwracalnemu zmniejszeniu. Brak lub zmniejszenie tej potrzeby negatywnie wpływa na interakcje w sieciach neuronalnych i szlakach odpowiedzialnych za czuwanie mózgu. Zmiany aktywności elektrycznej zachodzące w mózgu w okresach NREM i REM pod wpływem czynników neurohumoralnych wywołują różne mechanizmy fizjologiczne w organizmie. Sieci motoryczne są zintegrowane podczas REM, a niemotoryczne podczas NREM. Tak więc choroby, które wpływają na narządy i układy ciała, a także leki mogą zmieniać aktywność NREM i REM, a tym samym zmieniać funkcje motoryczne i sensoryczne mózgu. Można z łatwością stwierdzić, że wiele podstawowych i klinicznych zdarzeń neurofizjologicznych, które mają miejsce podczas czuwania, jest w rzeczywistości realizowanych poprzez procesy fizjologiczne i mechanizmy patofizjologiczne zachodzące podczas snu. Zaburzenia lękowe, depresja i schizofrenia, w których zaburzone są relacje neuroprzekaźników z receptorami, a także motoryczne i niemotoryczne choroby zwyrodnieniowe (stwardnienie zanikowe boczne, choroba Parkinsona) objawiają się zaburzeniami snu i zmianami zachowania w fazie REM na wiele lat przed wystąpieniem objawów klinicznych. Sen jest równie ważnym elementem życia jak czuwanie. W miarę jak będziemy rozumieć sen, wiele przyczyn podstawowych i klinicznych procesów zachodzących od wieku dziecięcego do geriatrycznego będzie coraz bardziej zrozumiałych.
Neurofizjologia podstawowych molekuł wpływających na mechanizmy snu i czuwania, podstawy farmakologii snu
Związek między zachowaniem, układem limbicznym i autonomicznym układem nerwowym
Kiedy mówimy o mózgu, myślimy o korze mózgowej; kiedy mowa o korze mózgowej, koncentrujemy się na czynnościach kory somatosensorycznej (zmysły) i somatomotorycznej (ruch);
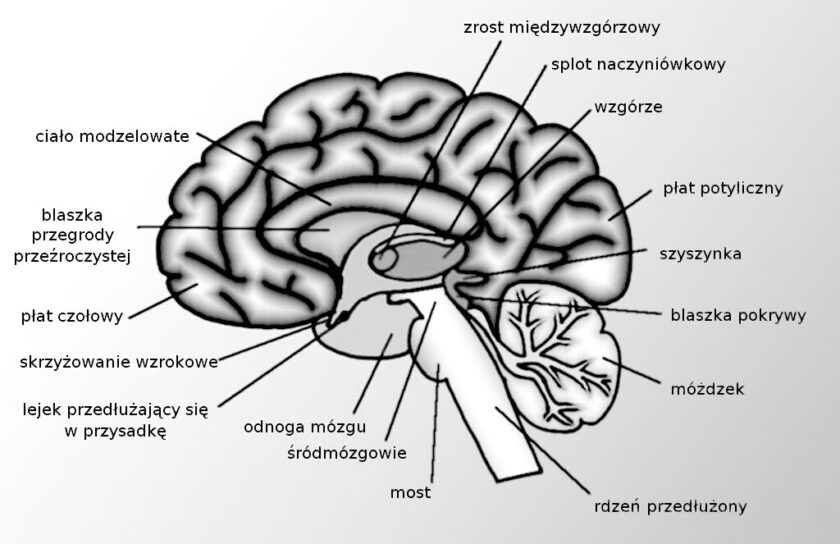
Kiedy słyszymy o podwzgórzu, zastanawiamy się nad hormonami podwzgórzowo-przysadkowymi i mechanizmami sprzężenia zwrotnego. Człowiek nie jest jednak ograniczony do funkcji biologicznych. Zachowanie jest tym, co definiuje istotę ludzką. Cechy fizjologiczne i społeczne związane z zachowaniami, a nawet nawykami, mogą wpływać na rozwój chorób i stosowane metody leczenia. Powstanie zachowania jest zarządzane przez układ limbiczny, który sam w sobie oznacza ograniczenie. Podwzgórze znajduje się w centrum układu limbicznego; zamiast skupiać się głównie na interakcjach biologicznych i sprzężeniu zwrotnym, odgrywa ono kluczową rolę w integracji i kontroli zachowania . Najważniejszym elementem cyklu snu i czuwania jest nasz model zachowania.
Sen jest najbardziej podstawową potrzebą fizjologiczną i najważniejszą aktywnością elektryczną mózgu wpływającą na zachowania w stanie czuwania (pragnienie, głód, sytość, stan emocjonalny, nastrój, motywacja społeczna, miłość, współczucie, spór, strach, uwaga, koncentracja, uczenie się, pamięć i wiele innych funkcji poznawczych, motorycznych, sensorycznych i autonomicznych) . W centrum mózgu głębokiego znajduje się podwzgórze, które wraz z otaczającymi je strukturami limbicznymi zarządza doznaniami afektywnymi (sympatia/niechęć, zadowolenie/wstręt, nagroda/kara). Jako główny ośrodek integracji, podwzgórze wykorzystuje włókna przywspółczulne i współczulne autonomicznego układu nerwowego, wytwarzając mechanizmy wegetatywne, emocjonalne i motywacyjne.
Amygdala – ciało (jądro) migdałowate, jest główną strukturą limbiczną odpowiedzialną za emocje:
1) Stymuluje aktywność współczulną, zwłaszcza wcześniej wyuczone zachowania związane z lękiem.
2) Może być dobrowolne, kiedy kora mózgowa decyduje się na przywołanie przerażających doświadczeń, działa za pośrednictwem ciała migdałowatego.
3) Niektórzy ludzie potrafią regulować niektóre czynności autonomiczne, uzyskując nadzwyczajną kontrolę nad swoimi emocjami.
4) Jest ono wrażliwe na brak snu, dlatego też, gdy nie śpisz wystarczająco dużo, stajesz się rozdrażniony. Formacja siateczkowa pnia mózgu, regulacja wielkości źrenic, oddychania, pracy serca, ciśnienia krwi, połykania itp.
Cykl snu i czuwania jest złożonym połączeniem wszystkich tych procesów fizjologicznych i behawioralnych.
Podczas snu wyróżnia się dwie fazy: fazę, w której nie występują szybkie ruchy gałek ocznych NREM (Non Rapid Eye Movement) oraz fazę, w której występują szybkie ruchy gałek ocznych REM (Rapid Eye Movement). Etapy te są oddzielone od siebie i od czuwania sztywnymi granicami .
Neuroanatomia zachowania w czasie snu i czuwania
Istnieją dwa główne regiony (mezopontynowy siatkowaty układ aktywujący (RAS) i podwzgórze; te dwa centralne regiony modulują wzgórze śródprzegrodowe i neurony znajdujące się w przodomózgowiu) oraz stymulator okołodobowy (jądro nadskrzyżowaniowe (SCN)), które odgrywają centralną rolę w regulacji cyklu snu i czuwania: RAS stymuluje korę mózgową drogami brzusznymi i grzbietowymi. Przewód brzuszny stymuluje przednie części mózgu przez podwzgórze i wzgórze, a przewód grzbietowy – przez grupy jąder we wzgórzu. W czasie czuwania przekazywanie informacji sensorycznych ze wzgórza jest możliwe dzięki kontroli RAS zarządzanej przez wzgórze. W czasie snu aktywność RAS ustaje, a przekazywanie informacji sensorycznych przez wzgórze jest zablokowane i nie dochodzi do pobudzenia kory mózgowej. Struktury anatomiczne odpowiedzialne za podwzgórzową kontrolę snu i czuwania: w stanie czuwania bodźce pochodzące z rostralnej części móżdżku i ogoniastych obszarów śródmózgowia docierają do paramedialnego śródmózgowia w ciemieniowej części mózgu, gdzie sygnały rozdzielają się na dwie drogi, zmierzając do wzgórza i podwzgórza. Główne struktury rzutujące do wzgórza to jądra PedinculoPontine Tegmental (PPT) i LateroDorsal Tegmental (LDT), które mają charakter cholinergiczny. Uważa się, że strukturą inicjującą sen jest ventrolateral preoptic nucleus (VLPO), zlokalizowane w przedniej części podwzgórza. Jądro VLPO hamuje aktywność pnia mózgu, opon mózgowych i jądra koeruletowego (LC), jądra grzbietowego grzbietu (RN), jądra bocznego grzbietu tegmentu pedinculopontine tegmental nucleus za pośrednictwem neuroprzekaźników GABA i galaniny. Jądro nadskrzyżowaniowe (SCN) jest znane jako światłoczuły stymulator rytmu okołodobowego. W ciągu dnia bodziec świetlny jest przekazywany drogami neuronowymi z siatkówki do podwzgórza, co powoduje wydzielanie melatoniny przez szyszynkę. Jest to struktura anatomiczna, która odgrywa centralną rolę w utrzymaniu rytmu dzień-noc . Jest ona wielosynaptyczna, do czego przyczynia się współczulny układ nerwowy.
Fizjologia neuroprzekaźników odpowiedzialnych za sen i czuwanie
Podstawowe neuroprzekaźniki cyklu snu i czuwania oraz neurohormony
Dopamina: Syntetyzowana jest z L-Dopy przy udziale enzymu dekarboksylazy aromatycznego L-aminokwasu (kofaktor pirydoksyna).
Receptory dopaminowe:
Receptor D1; znajduje się w szlaku nigrostriatalnym, a konkretnie w jądrze ogoniastym, odgrywa rolę w inicjacji ruchów układu ruchowego.
Receptor D2; występuje głównie w prążkowiu i drogach mezolimbicznych, odgrywa rolę w efektach motorycznych związanych z układem pozapiramidowym.
Receptor D3; znajduje się głównie w układzie limbicznym, odgrywa ważną rolę w procesach emocjonalnych i poznawczych.
Receptor D4; jego liczba jest zwiększona w schizofrenii.
Receptor D5; jest ważny dla równowagi dopaminowo-acetylocholinowej w zwojach podstawy oraz dla utrzymania prawidłowego napięcia mięśni somatycznych i poprzecznie prążkowanych. Parkinson i pląsawica Huntingtona są prototypowymi chorobami, w których występuje odpowiednio zmniejszona i zwiększona aktywność dopaminergiczna. Dopamina zmniejsza wydzielanie prolaktyny i TRH .
Serotonina (5-hydroksytryptamina, 5-HT): L-tryptofan jest przekształcany w 5-hydroksytryptaminę (5-HT) przy udziale hydroksylazy tryptofanowej (5-hydroksytryptofan) i enzymów dekarboksylazy aminokwasowej. Większość szlaków serotoninergicznych znajduje się w systemie Raphe (2 szlaki) w mózgu.
1) Szlak wstępujący: Regulacja zachowań żywieniowych (zmniejsza apetyt wraz z histaminą i nikotyną), kontynuacja normalnych wzorców zachowań, regulacja cyklu snu-NREM-REM, regulacja hormonalna (zwiększa wydzielanie ACTH i prolaktyny, zmniejsza wydzielanie GnRH), depresja, lęk i patogeneza migreny.
2) Szlak zstępujący: Działa jako modulator w przekazywaniu wrażeń bólowych do poziomu centralnego. Receptory serotoninowe: 5HT1-A: wykazują działanie anksjolityczne. 5HT1-B: Jest inhibitorem presynaptycznym. 5HT1-D: Zamyka kanały AV w mózgu, odgrywa rolę w patogenezie migreny. 5HT2: ma działanie pobudzające na zachowanie. 5HT2-C: Występuje szczególnie w splocie naczyniówkowym, gdzie swoje działanie wywiera atypowy lek przeciwpsychotyczny – klozapina. 5HT3: Stymuluje ośrodek oddechowy i występuje w autonomicznym układzie nerwowym. 5HT4: Występuje głównie w splocie mięśniowym w obrębie układu pokarmowego .
Adenozyna: Jest nukleozydem naturalnie występującym we wszystkich komórkach organizmu. Tworzy cząsteczki takie jak trójfosforan adenozyny (ATP) i difosforan adenozyny (ADP) w celu przekazywania energii wewnątrz komórek; jednocześnie jest jednym z chemicznych posłańców (ksantyna) lub neuroprzekaźników w mózgu. Jest to substancja, która jest wytwarzana bezpośrednio lub w wyniku hydrolizy ATP. Rozkładana jest przez deaminazę adenozyny.
Posiada 2 znane receptory: P1 (A1-4) oraz (receptory A1 i A2 są blokowane przez metyloksantyny) P2X-2Y. Działa depresyjnie na OUN. Jako przekaźnik hamujący w mózgu, wykazuje narastający wzrost specyficznie w RAS przez cały okres czuwania; kiedy osiąga najwyższy poziom, następuje zahamowanie adenozyny, rozpoczyna się sen, a stężenie adenozyny stopniowo zmniejsza się podczas snu. Kofeina blokuje depresyjne działanie adenozyny na mózg, zmniejsza hamowanie adenozyny i zapewnia kontynuację czuwania, natomiast karbamazepina (agonista adenozyny, lek przeciwpadaczkowy) pomaga kontynuować hamowanie adenozyny .
Melatonina (neurohormon określający porę dnia i nocy): Odgrywa ważną rolę w określaniu rytmu okołodobowego. Jest syntetyzowana z 5-HT w szyszynce przez enzymy acetylotransferazę i metylotransferazę. Receptory dla melatoniny znajdują się głównie w SCN. W fizjologicznym działaniu melatoniny pośredniczą dwa sprzężone z białkiem G receptory błonowe, należące do rodziny reduktaz chinonowych.
Receptory melatoniny: MT1; występuje głównie w skórze człowieka. Związane są z procesem starzenia się i chorobą Alzheimera. Receptory MT1 i MT2 ulegają ekspresji w SCN i pełnią odmienne funkcje w regulacji snu. Aktywacja receptora MT1 hamuje szybkość odpalania neuronów w SCN, podczas gdy MT2 działa głównie poprzez indukowanie przesunięć faz rytmu okołodobowego. MT2; ma działanie anksjolityczne, przeciwdepresyjne i hipnotyczne oraz jest związany z patofizjologią bólu. MT3; jest związany z enzymem reduktazy chinonowej i odgrywa rolę w zapobieganiu stresowi, a także w detoksykacji .
Neuroprzekaźniki odpowiedzialne za sen i czuwanie
“Glutaminian, acetylocholina, histamina, noradrenalina i GABA”.
Glutaminian: Jest głównym neuroprzekaźnikiem pobudzającym w mózgu i rdzeniu kręgowym (medulla spinalis). Jego nieaktywną formą jest glutamina. Odgrywa podstawową rolę w generowaniu pobudzających potencjałów postsynaptycznych i potencjałów długotrwałych w mózgu, które są najważniejszymi mechanizmami w procesie uczenia się i tworzenia pamięci. Najważniejszymi jej receptorami są: NMDA (N-methyl-D-aspartate; jest to receptor typu kanału Na+-K+-Ca++, jego selektywnym antagonistą jest fencyklidyna, a endogennym blokerem – Mg++), AMPA (alfa-amino-3-hydroxy-5 methyl-4- isoxazole propionic acid), receptory kainianowe (kainic asid) (KARs) .
Acetylocholina: W OUN posiada receptory muskarynowe i nikotynowe. Prawie 80% szlaków cholinergicznych w mózgu pochodzi z jądra podstawy Meynerta. Receptory nikotynowe znajdują się głównie w komórkach Renshawa, które hamują neurony ruchowe alfa w rdzeniu kręgowym (medulla spinalis). Oprócz funkcji związanych z uczeniem się i pamięcią, odgrywają one również rolę w zrównoważonym funkcjonowaniu układu pozapiramidowego. Wykazano paralelizm między degeneracją tego szlaku a występowaniem choroby Alzheimera i pląsawicy Huntingtona .
Histamina: Podwzgórze tylne brzuszne i jądro tuberomilarego (TMN) otrzymujące projekcje histaminergiczne mają największe stężenie neuronów histaminergicznych w mózgu. Receptory H1 znajdują się w komórkach glejowych, a receptory H3 w zwojach podstawnych.
Działanie histaminy podobne do działania serotoniny polega na:
1) zmniejszaniu apetytu oraz
2) zwiększaniu wydzielania ACTH i prolaktyny .
Noradrenalina: W OUN neurony katecholaminergiczne występują najliczniej w locus coeruleus. Największe stężenie noradrenaliny występuje w podwzgórzu, jądrze migdałowatym i zakręcie zębatym hipokampa. Formacja siateczkowo-śródplazmatyczna zawiera największe ilości adrenaliny. Posiada receptory aktywatora Beta 1 i 2, które są szeroko rozpowszechnione w OUN. Alfa 1 powoduje czujność (aktywację behawioralną). Alfa 2 działa jako autoreceptor na poziomie presynaptycznym i ma charakter hamujący (uspokojenie). Aktywacja tego układu w OUN prowadzi do reakcji panicznej objawiającej się czujnością, strachem i stanem alarmowym. Ponadto wywołuje lęk i drżenie. Zmniejszenie skuteczności tego układu prowadzi natomiast do depresji. Katecholaminy zwiększają również wydzielanie GnRH i ACTH .
Kwas gamma-aminomasłowy (GABA): Jest to główny mediator hamujący w mózgu. GABA jest syntetyzowany z kwasu glutaminowego przez enzym dekarboksylazę kwasu glutaminowego (aktywowany przez kwas walproinowy). Główną drogą jego inaktywacji w przestrzeni synaptycznej jest wychwyt zwrotny, gdzie jest rozkładany do semialdehydu kwasu bursztynowego przez enzym transaminazę GABA (hamowany przez wigabatrynę).
Posiada dwa receptory o charakterze inhibitorowym:
1) Receptor GABA-A jest kanałem chlorkowym. Po jego aktywacji, na skutek napływu jonów Cl, wzrasta ujemne napięcie wewnątrzkomórkowe (hiperpolaryzacja). Receptor ten ma 5 podjednostek (2 alfa, 2 beta, 1 gamma): Agonistą dla podjednostki beta jest muscimol, a jej antagonistą – biklukulina; podjednostka alfa jest receptorem benzodiazepinowym. Barbituran jest agonistą kanału Cl, natomiast pikrotoksyna i pentylenetetrazol są antagonistami. Posiada regiony wiążące dla etanolu i iwermektyny.
2) Receptor GABA-B nie ma charakteru kanału jonowego. Nie działa na niego benzodiazepina ani barbiturany. Jest aktywowany przez baklofen, a antagonizowany przez faclofen i saklofen .
Mechanizm działania neurotransmiterów na neurony snu i czuwania
Układ aktywujący siatkówki pobudza korę mózgową za pomocą glutaminianu, natomiast neurony tegmentalne ponto-mesencephaliczne za pomocą acetylocholiny. Neurony w locus coeruleus wykorzystują głównie noradrenalinę, rozciągają się od pnia mózgu do kory mózgowej, obejmując przodomózgowie; aktywując stymulację kory mózgowej, przyczyniają się do utrzymania czuwania. Sieć neuronów cholinergicznych prowadzi do czuwania w dwóch typach kory:
Projekcje do jąder tegmentalnych bocznych i pedinculopontine tegmental nuclei, jąder wzgórzowych środkowych i intralaminarnych oraz w mniejszym stopniu do bocznego podwzgórza i podstawy przodomózgowia.
Grupa neuronów cholinergicznych rozpoczyna się w przodomózgowiu podstawnym i ma rozległą projekcję do kory mózgowej. Ta grupa neuronów ponadzmysłowych jest częścią wstępującego układu aktywacji siateczkowej; odgrywają one rolę w aktywacji podczas czuwania i są aktywnie zaangażowane w sen paradoksalny. Glutaminian jest kolejnym neuroprzekaźnikiem pobudzającym, działającym jako podstawowy neuroprzekaźnik wstępującego układu aktywacji siateczkowej. Glutaminian występuje w bardzo dużych stężeniach w tworze siatkowatym pnia mózgu. Odgrywa on aktywną rolę w mózgu w stanie czuwania i jest wydzielany z komórek korowych podczas czuwania. Podczas snu głębokiego, snu z wolnymi falami (SWS) pojawiają się “wyładowania rozrywające”, będące wynikiem aktywacji specjalnych receptorów glutaminianu. Histamina odgrywa również ważną rolę w stanie czuwania. Neurony zawierające histaminę znajdują się w jądrach tuberomammillarnych i tylnej części podwzgórza. Neurony noradrenergiczne (locus coeruleus) mają rozproszone projekcje w mózgu, rozciągające się do kory mózgowej. Neurony histaminergiczne są związane z aktywacją korową podczas czuwania, natomiast są wyłączone podczas snu REM. Sen wymaga przejścia od regulacji współczulnej do regulacji przywspółczulnej. Istotne ośrodki przywspółczulne znajdują się w “neuronach jądra przewodu samotnego, przedniego podwzgórza i pól przedwzrokowych”. Kiedy wzrastające stężenie adenozyny w RAS osiąga najwyższy poziom, neurony serotoninergiczne raphe ułatwiają rozpoczęcie snu, podczas gdy neurony GABA-ergiczne hamują układ aktywujący. Te neurony GABA-ergiczne są selektywnie aktywowane podczas SWS. W wyniku tego hamowania dochodzi do supresji pnia mózgu, podwzgórza i przodomózgowia nosowego, a także do dezfacylitacji (zahamowania) i hiperpolaryzacji układu wzgórzowo-korowego. W ten sposób ze stanu czuwania, w którym na EEG obserwujemy szybkie, toniczne wyładowania, system przechodzi w stan snu, w którym zaczynamy rejestrować wrzeciona senne i aktywność wolnofalową. Inicjacja i kontynuacja SWS jest możliwa dzięki wydłużeniu i wzmocnieniu hamowania układu aktywującego przez układ GABA-ergiczny. Szybkość metabolizmu adenozyny dyktuje wrażliwość na deprywację snu, wpływając bezpośrednio na jakość i czas trwania SWS .
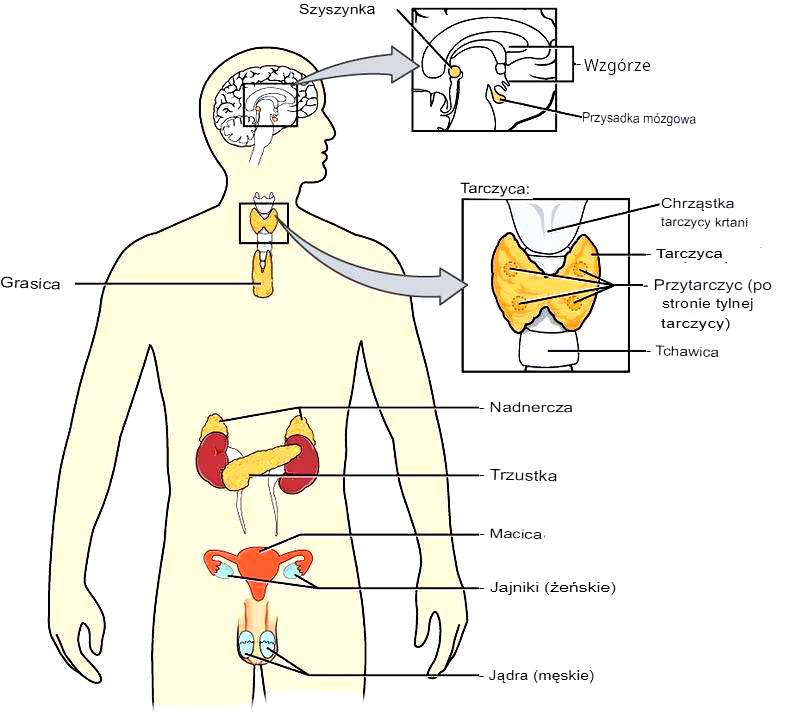
Fizjologia układu okołodobowego i melatonina w regulacji rytmu okołodobowego
W języku łacińskim circa oznacza odnoszący się do, a dian oznacza dzień; circadian to słowo używane do wyjaśnienia dobowych rytmów fizjologicznych organizmu, głównie snu i czuwania.
Anatomia rytmu okołodobowego: Regionami odpowiedzialnymi za rytm okołodobowy u ssaków są prawe i lewe jądro nadskrzyżowaniowe (SCN) znajdujące się w przedniej części podwzgórza. Na podstawie struktury biochemicznej, fenotypów peptydowych i szlaków aferentno-efferentnych SCN dzieli się na część brzuszno-boczną i grzbietowo-boczną. Na SCN wpływają zmiany środowiskowe, takie jak światło i czas odżywiania. SCN posiada również obszary funkcjonalne, które regulują wyjścia rytmu okołodobowego związane z aktywnością neuronów. Światło jest odbierane przez fotoreceptory siatkówki (czopki, pręciki, komórki zwojowe siatkówki zawierające melanopsynę). Potencjały czynnościowe, które są tu generowane, prowadzą do wydzielania glutaminianu i polipeptydu aktywującego cyklazę adenylanową przysadki poprzez drogi siatkówkowo-podwzgórzowe. Informacja o natężeniu światła i bodźcu czasowym jest przekazywana bezpośrednio do SNC, natomiast pośrednio do okolicy bocznej genikulusa we wzgórzu. SCN otrzymuje znaczące sygnały z serotoninergicznego jądra środkowego rzepaku oraz z obszaru intergenikularnego zawierającego neuropeptyd Y i GABA (obszary te nie są niezbędne dla rytmu okołodobowego; przekazują one jednak do ośrodka rytmu okołodobowego informacje o zmianach fazowych wrażliwych na światło oraz o bodźcach innych niż światło). Wpływ światła na aktywność SCN i zmiany fazowe rytmu okołodobowego jest całkowicie odwrotny niż wpływ neuropeptydu Y i serotoniny. Jako ośrodek rytmu okołodobowego SCN bierze udział w regulacji rytmów behawioralnych, fizjologicznych i genetycznych.
Najważniejszym aspektem jest jej związek z podwzgórzem;
1) Główny szlak neuronalny regulujący rytm sen-czuwanie SCN – sąsiednia okolica nadwzgórza, SCN – grzbietowo-przyśrodkowa okolica podwzgórza
2) SCN – wysyła zarówno bezpośrednie, jak i pośrednie włókna do jądra przyśrodkowego podwzgórza regulującego wydzielanie kortykosteroidów i syntezę melatoniny.
Regulacja rytmu okołodobowego poprawia przystosowanie organizmu do życia; pod koniec snu wzrasta temperatura ciała, stężenie kortyzolu w osoczu i autonomiczna aktywność układu współczulnego. Kiedy zbliża się pora snu, temperatura ciała obniża się i rozpoczyna się wydzielanie melatoniny. U ssaków ośrodek rytmu okołodobowego w SCN reguluje fazy i czas wszystkich cyklicznych funkcji behawioralnych oraz cykl sen-czuwanie. Identyfikacja szlaków neuronalnych i neuroprzekaźników odgrywających rolę w tej regulacji ma kluczowe znaczenie dla opracowania farmakologicznych i strategicznych metod leczenia chronobiologicznych zaburzeń snu . Melatonina w regulacji snu i rytmu okołodobowego: Melatonina jest neuroendokrynnym modulatorem rytmu dzień-noc, a jej receptory są gęsto rozmieszczone w jądrze nadskrzyżowaniowym (SCN). Endogenny rytm okołodobowy wydzielania melatoniny jest wprost proporcjonalny do endogennego rytmu skłonności do snu. Wydzielanie melatoniny z szyszynki jest kontrolowane przez SCN. Szlak ten jest wielosynaptyczny i ma udział współczulnego układu nerwowego. Podawana do organizmu z zewnątrz melatonina pomaga w inicjacji snu, a ponieważ prowadzi do przesunięć fazowych, ma działanie terapeutyczne w bezsenności i regulacji faz sen-czuwanie. Zegar biologiczny może być traktowany jako zabezpieczenie przed przesunięciami faz snu spowodowanymi zmianami homeostatycznymi.
Gdy człowiek zamierza dowolnie zmieniać rytm snu i czuwania (najczęstsze przyczyny to podróże do regionów o różnym czasie i praca w systemie zmianowym), dochodzi do bezsenności.
Regulacja snu, homeostaza, homeostaza snu i rytm sen-czuwanie:
W regulacji snu odgrywają rolę trzy główne procesy:
1) Proces homeostatyczny, który mówi nam o relacji między ostatnimi okresami snu i czuwania. W organizmach pozbawionych snu czas trwania i głębokość snu zwiększa się jako mechanizm kompensacyjny.
2) Proces cyrkadialny, czyli inaczej mówiąc zegar biologiczny.
3) Proces ultradianowy, który określa czas trwania cykli snu REM-NREM oraz interakcje między nimi. Rytm snu i czuwania jest określany przez procesy cyrkadialne i homeostatyczne. Homeostaza to zachowanie wymaganych warunków środowiska wewnętrznego (płynu pozakomórkowego) dla utrzymania żywotności organizmu. Homeostaza snu jest odpowiednikiem równowagi między snem a czuwaniem w regulacji snu. Równowaga ta jest utrzymywana przez mechanizmy homeostatyczne, a odchylenia od normy są albo normalizowane, albo przybliżane do normy. Proces cyrkadialny może być traktowany jako wewnętrzny zegar, który działa przez 24 godziny. Proces homeostatyczny jest związany z czasem spędzonym na czuwaniu przed snem.
Dlatego też istnieją trzy ważne cechy leku, który ma być stosowany w leczeniu bezsenności spowodowanej zmianami zegara okołodobowego:
1) Działanie hipnotyczne: zdolność do zapoczątkowania lub utrzymania snu, gdy działanie homeostatyczne jest do tego niewystarczające.
2) Efekt chronohipnotyczny: zdolność do hamowania czasu budzenia się, który jest normalnie regulowany przez ośrodek okołodobowy.
3) Efekt chronobiotyczny: w odniesieniu do regulacji rytmu okołodobowego, zdolność do inicjowania przesunięć fazowych i dokonywania ich w pożądanych godzinach.
Melatonina jest hormonem, który posiada wszystkie te trzy cechy. Wydzielanie melatoniny z szyszynki jest kontrolowane przez SCN. Ponadto jest ona wielosynaptyczna i ma swój udział w OUN. Jeśli w godzinach nocnych dochodzi do ekspozycji na światło, poziom melatoniny natychmiast się obniża.
Na stężenie melatoniny wpływają niektóre leki: Beta-blokery stosowane w profilaktyce nadciśnienia tętniczego, zaburzeń rytmu serca i bólów głowy blokują aktywność współczulną zarówno w sercu, jak i w szyszynce. Z drugiej strony, lek przeciwdepresyjny fluwoksamina zapobiega degradacji melatoniny i zwiększa jej stężenie w osoczu. Podanie doustne 0,3-80 mg melatoniny w ciągu dnia, kiedy stężenie endogennej melatoniny jest niskie, powoduje skrócenie czasu zasypiania i działa indukująco na sen. Działanie melatoniny jest związane z postawą ciała; zwiększa się w pozycji leżącej, a zmniejsza w pozycji stojącej. Zaburzenia równowagi neuroprzekaźników występują w SCN pacjentów z nadciśnieniem tętniczym, a w następstwie choroby wieńcowej dochodzi do zmniejszenia wydzielania melatoniny. Wykazano, że u chorych z niekontrolowanym nadciśnieniem tętniczym przyjmowanie 2,5 mg melatoniny na 1 godzinę przed snem wydłuża całkowity czas trwania i skuteczność snu.
Wzorzec EEG regulacji snu:
Regulacja snu jest określana głównie przez homeostazę snu: w przypadku niedoboru snu długość snu zwiększa się, a sen staje się głębszy jako mechanizm kompensacyjny. Ponieważ zapotrzebowanie na sen jest określane przez procesy homeostatyczne i okołodobowe. Wraz ze wzrostem czasu spędzonego na czuwaniu przed snem wzrasta ilość fal wolnych w EEG snu, a zmniejsza się ilość wrzecion sennych. Neurofizjologicznie, neurony wzgórzowo-korowe wykazują umiarkowany poziom hiperpolaryzacji podczas powierzchownych stadiów snu NREM (N1 i N2) i wysoki poziom polaryzacji podczas głębokich stadiów (N3) NREM. Podczas powierzchownego snu NREM częściej występują wyładowania wzgórzowo-korowe, których odpowiednikiem w EEG są wrzeciona snu. Aktywność theta w EEG w stanie czuwania wskazuje na proces homeostazy. W miarę wydłużania się okresu czuwania wzrasta aktywność theta i w takim samym stopniu wzrasta aktywność SWS (delta). Mimo że mechanizmy działania tych leków są różne, to podobnie jak benzodiazepiny, stosowanie melatoniny hamuje aktywność EEG o niskiej częstotliwości .

Wpływ snu i rytmu okołodobowego na hormony
Rytmiczność okołodobowa i homeostaza snu i czuwania obejmuje:
1) modulację hormonów, peptydów i cząsteczek podwzgórza,
2) szlaki metaboliczne, na które wpływają hormony obwodowe oraz
3) kontrolę autonomicznego układu nerwowego nad narządami endokrynnymi.
W regulacji czasowej organizacji wydzielania hormonów równie skuteczne jak rytm okołodobowy i procesy homeostatyczne są procesy związane ze zmianami sygnału elektrycznego w fazach snu mózgu (NREM-REM). Procesy te oddziałują na różne osie hormonalne (somatotropową, kortykotropową i gonadową) oraz szlaki metaboliczne na różnych poziomach. Na przykład stężenie hormonu tyreotropowego (TSH) może zmieniać się zarówno podczas snu, jak i w rytmie okołodobowym, podczas gdy stężenie kortyzolu zmienia się tylko w rytmie okołodobowym. Poziom hormonu wzrostu (GH) i prolaktyny (PRL) może być na pewnym poziomie podczas czuwania w ciągu dnia, ale wzrasta podczas snu. Wykazano, że glukoza i insulina są zależne zarówno od snu, jak i od rytmu okołodobowego, a ich poziom wzrasta podczas czuwania w nocy i podczas snu w ciągu dnia. Oscylacje okołodobowe mogą być generowane w wielu narządach peryferyjnych pod kontrolą autonomicznego układu nerwowego, w tym w adipocytach i komórkach beta trzustki, które generują sygnały endokrynne. Te “lokalne” oscylatory wydają się być kontrolowane przez centralne baterie elektryczne znajdujące się w jądrach nadskrzyżowaniowych albo bezpośrednio przez sygnały neuronalne i endokrynologiczne, albo pośrednio przez cykl sen-czuwanie i rytmy behawioralne, takie jak odżywianie. Endokrynne wydzielanie tych obwodowych oscylatorów podczas czuwania i snu oraz ich możliwy udział w czasowej organizacji funkcji metabolicznych są nadal przedmiotem badań .
Oś somatotropowa i sen
Hormon wzrostu (GH): Wydzielanie GH przez przysadkę mózgową jest stymulowane przez podwzgórzowy hormon wydzielania GH (GHRH) i hamowane przez somatostatynę. Acylowana forma greliny, która jest produkowana głównie w żołądku, wiąże się z receptorami wydzielania hormonu wzrostu (GHS) i endogennie stymuluje wydzielanie GH. GH jest środkiem pobudzającym oddychanie. W badaniach na zwierzętach wykazano, że infuzja GHRH i greliny powoduje SWS, podczas gdy infuzja GH prowadzi do snu REM. Istnieje stały związek między obecnością fal delta w EEG a wysokim stężeniem GH, a maksymalne wydzielanie GH ma miejsce kilka minut po rozpoczęciu SWS. Środki farmakologiczne stosowane w narkolepsji, takie jak maślan gamma-hydroksylu (GHB) i ritanseryna, które stymulują SWS, powodują wzrost GH. Wydzielanie GH w czasie snu jest regulowane przez stymulację GHRH, która ma miejsce przede wszystkim podczas hamowania wydzielania somatotropin, kiedy to zmniejsza się aktywność somatotropin. Wydzielanie GH podczas wczesnego snu jest hamowane przez podanie antagonisty GHRH . SWS zmniejsza się wraz z wiekiem, a ponadto istnieją schorzenia powodujące fragmentację snu, które zmniejszają wydzielanie GH. Deprywacja snu wpływa na wydzielanie GH poprzez pogorszenie zarówno rytmu okołodobowego, jak i homeostazy sen-czuwanie. Insulinopodobny czynnik wzrostu (IGF-1) (somatomedyna C): Jest to hormon syntetyzowany głównie w wątrobie w wyniku stymulacji GH. Pośredniczy w anabolizującym działaniu GH w tkance mięśniowej. U mężczyzn obniża się po 21 roku życia, natomiast u kobiet po menopauzie następuje gwałtowny spadek. Jest stymulantem oddychania, podobnie jak GH, i prowadzi do zwiększenia SWS.
Somatostatyna: Hamuje stymulację wydzielania GH przez GHRH. Ma działanie supresyjne na ośrodek oddechowy i uważa się, że odgrywa rolę w zespole nagłej śmierci niemowląt .
Oś kortykotropowa a sen
Aktywność osi kortykotropowej jest związana z reakcją na stres i aktywacją behawioralną. Aktywność osi kortykotropowej może być mierzona obwodowo poprzez stężenie w osoczu hormonu adrenokortykotropowego przysadki mózgowej (ACTH) oraz kortyzolu, który jest bezpośrednio kontrolowany przez stymulację ACTH. Stężenie tych hormonów w osoczu jest najwyższe we wczesnych godzinach porannych, obniża się w ciągu dnia, osiągając najniższy poziom w późnych godzinach nocnych i we wczesnych fazach snu. Dlatego sen jest zwykle inicjowany, gdy aktywność kortykotropowa jest wolna. Reaktywacja wydzielania ACTH i kortyzolu następuje nagle, na kilka godzin przed przebudzeniem.
Hormon uwalniający kortykotropinę (CRH): Reguluje wydzielanie GnRH i stymuluje wydzielanie hormonu adrenokortykotropowego (ACTH) z przysadki mózgowej. Wiąże się z receptorami CRH, których jest wiele w mózgu, i stymuluje oddychanie. W przypadku stresu działa jako element osi podwzgórze-przysadka-nadnercza i zwiększa stężenie kortyzolu w osoczu.
Kortyzol: Fizjologicznie niski poziom kortyzolu na początku snu jest skorelowany z SWS, a wydzielanie kortyzolu rozpoczyna się głównie podczas powierzchownych faz snu. W przypadku niedoboru snu stężenie kortyzolu działa równolegle do rytmu okołodobowego, wzrastając i malejąc w tym samym czasie; ponieważ jednak zmienia się pora rozpoczynania i kończenia snu, stężenie kortyzolu jest nieco wyższe w nocy (gdzie powinno być niższe) i nieco niższe w dzień (gdzie powinno być wyższe) (przez co amplituda rytmu kortyzolu zmniejsza się). U osób starszych z fragmentarycznym snem i obniżoną SWS, obserwowane pogorszenie pamięci i insulinooporności jest związane z podwyższonym poziomem kortyzolu w nocy. Budzenie się podczas fragmentarycznego snu powoduje wzrost stężenia kortyzonu (jeśli chodzi o wzrost kortyzolu i fragmentację snu, nie jest jasne, co jest przyczyną, a co skutkiem). U pacjentów z zespołem Cushinga wykazano złą jakość snu, zmniejszenie latencji REM, zwiększenie intensywności pierwszego REM i zmniejszenie snu głębokiego. U pacjentów z zespołem Addisona również obserwowano obniżenie jakości snu głębokiego. Można zatem stwierdzić, że aby sen głęboki mógł zaistnieć, organizm potrzebuje rytmu kortyzolu w granicach normy .
Oś tyreotropowa i sen
Hormon stymulujący tarczycę (TSH)-Trójjodotyronina (T3)-Tyroksyna (T4): Jest stabilny w ciągu dnia i wzrasta we wczesnych godzinach wieczornych, osiągając maksymalny poziom na początku snu. Przed porannym przebudzeniem wraca do stabilnego poziomu, który utrzymuje się przez cały dzień. Na wydzielanie TSH wpływa rytm okołodobowy i sen. Sen ma hamujący wpływ na TSH. Efekt ten zanika podczas niedoboru snu, nocne stężenie TSH wzrasta wraz ze wzrostem T3 i T4. Hormony tarczycy są substancjami pobudzającymi oddychanie. W niedoczynności tarczycy występuje tendencja do hipowentylacji i zespołu obturacyjnych bezdechów. Występuje senność w ciągu dnia i obniżenie SWS. W nadczynności tarczycy występuje wzmożona ruchliwość podczas snu, skrócenie czasu trwania REM i bezsenność z powodu zwiększonego tempa metabolizmu .
Prolaktyna (PRL) a sen
Stężenie PRL zaczyna wzrastać wkrótce po rozpoczęciu snu i osiąga szczyt nocny w połowie snu. Prawdopodobnie głównym mechanizmem leżącym u podstaw tego szczytu jest zmniejszone hamowanie dopaminergiczne PRL podczas snu. Hormon uwalniający tyreotropinę (TRH), wazoaktywny peptyd jelitowy (VIP), oksytocyna, estrogeny i angiotensyna II zwiększają wydzielanie PRL, podczas gdy dopamina, GABA i ostra hipoksja hamują to wydzielanie. Podstawowym działaniem PRL w czasie snu jest stymulacja snu REM. Uważa się, że szybki wzrost PRL na początku snu ma związek z SWS. U matek z prolaktynoma i matek karmiących SWS zwiększa się z powodu zwiększonego wydzielania PRL. Fragmentaryczny sen zmniejsza wydzielanie PRL (Mechanizm: Budzenie się rano i czuwanie, które fragmentują sen, są związane z szybkim hamowaniem wydzielania PRL) .
Oś gonadalna a sen
Związek między 24-godzinnym rytmem wydzielania gonadotropin a poziomem steroidów gonadalnych zmienia się w zależności od stadium dojrzałości i jest zależny od płci w okresie młodej dorosłości .
Gonadotropiny: Przed okresem dojrzewania hormon luteinizujący (LH) i hormon stymulujący pęcherzyki jajnikowe (FSH) są wydzielane w sposób pulsacyjny zarówno u chłopców, jak i u dziewcząt. Zwiększona amplituda wydzielania gonadotropin podczas snu jest charakterystyczna dla okresu dojrzewania. U dorastających dziewcząt stężenie estradiolu jest wyższe w ciągu dnia niż w nocy; u dorastających chłopców wysokie stężenie testosteronu w nocy zbiega się ze wzrostem stężenia gonadotropin. Zarówno sen, jak i rytm okołodobowy przyczyniają się do zwiększenia pulsacji gonadotropin w nocy u nastolatków. W miarę wchodzenia w dorosłość wpływ rytmu okołodobowego zmniejsza się lub całkowicie zanika. W przypadku niedoboru snu wzrasta LH, a FSH nie ulega zmianie. U dorosłych 24-godzinne stężenie LH w osoczu jest regulowane przez cykl menstruacyjny u kobiet, u mężczyzn zmienia się w zależności od cykli NREM-REM. U młodych mężczyzn deprywacja snu REM osłabia zwłaszcza nocny wzrost testosteronu. U starszych mężczyzn obserwuje się zmniejszenie wydzielania LH podczas snu, natomiast u starszych kobiet jego wzrost; nie jest to jednak związane z rytmem okołodobowym.
Progesteron: Zwiększa się w czasie ciąży i w fazie lutealnej cyklu miesiączkowego. Ponieważ jest on środkiem pobudzającym oddychanie, w tych okresach występuje niski poziom dwutlenku węgla i hiperwentylacja. Gdy progesteron zmniejsza się w okresie pomenopauzalnym, częściej obserwuje się nocną desaturację, hipopenię i bezdechy. U osób, którym w okresie pomenopauzalnym podawano estrogeny i progesteron, zaburzenia oddychania w czasie snu występowały rzadziej. Estrogen: U młodych kobiet jego najniższe stężenie występuje podczas menstruacji, a najwyższe w fazie środkowo-lutealnej (estradiol). W okresie postmenopauzy występuje w postaci estronu. Estradiol zwiększa wpływ progesteronu na oddychanie poprzez zwiększenie liczby receptorów progesteronowych.
Testosteron: Pomimo niewielkiej amplitudy nocnego wzrostu wydzielania gonadotropin, istnieje znaczący rytm dobowy dla stężenia testosteronu w krążeniu. Testosteron osiąga najniższe stężenie w późnych godzinach nocnych; po rozpoczęciu snu następuje jego silny wzrost, a maksymalne stężenie osiąga we wczesnych godzinach porannych. Dlatego też silny rytm okołodobowy testosteronu w osoczu może być częściowo kontrolowany przez czynniki inne niż LH. Nocny wzrost testosteronu jest czasowo związany z opóźnieniem pierwszego epizodu REM. Istnieją badania wskazujące, że problemy z oddychaniem w czasie snu wynikają z obniżenia stężenia testosteronu w godzinach nocnych, jak również badania wskazujące, że stymulacja oddechowa jest zmniejszona przez negatywny wpływ na progesteron.
Oś katecholaminergiczna i sen
Po rozpoczęciu snu poziom noradrenaliny i adrenaliny obniża się, podobnie jak kortyzolu, osiągając minimalny poziom w ciągu godziny. Noradrenalina odgrywa rolę w kontroli oddychania, podczas gdy adrenalina jest lekiem rozszerzającym oskrzela. Nocne stężenia katecholamin są podwyższone u pacjentów z zespołem obturacyjnego bezdechu.
Fizjologiczne mechanizmy działania podstawowych cząsteczek powodujących zmiany metaboliczne związane ze snem
Molekuły pośredniczące w regulacji odżywiania i snu
Sen odgrywa ważną rolę w bilansie energetycznym. Hipokretyny i oreksyny są neuropeptydami stymulującymi podwzgórze o silnym działaniu pobudzającym czuwanie, a także stymulują karmienie; ich definicja stworzyła molekularne podstawy do określenia interakcji między odżywianiem a regulacją snu.
Oreksyna: Neurony zawierające oreksynę w bocznym podwzgórzu prowadzą bezpośrednio do locus coeruleus i innych obszarów stymulowanych w pniu mózgu i podwzgórzu; tutaj wchodzą w interakcję z siecią neuronów wrażliwych na leptynę, która odgrywa rolę w równoważeniu przyjmowania pokarmu i zużycia energii. Neurony zawierające oreksynę są aktywne podczas czuwania i nieaktywne podczas snu. Aktywność oreksyny jest hamowana przez leptynę, która jest hormonem sytości, a stymulowana przez grelinę, hormon pobudzający apetyt.
Leptyna: Leptyna to hormon wydzielany przez adipocyty, który dostarcza ośrodkom regulacyjnym w podwzgórzu informacji o stanie energetycznym. Uważa się, że nocny wzrost leptyny tłumi głód podczas nocnego postu. Podana ogólnoustrojowo powoduje wzrost SWS i obniżenie REM. Ponieważ hamuje wydzielanie neuropeptydu Y (hamuje oddychanie), stymuluje wydzielanie hormonu uwalniającego kortykotropinę – CRH (stymuluje oddychanie). W badaniach wykazano, że stymuluje oddychanie, a leczenie CPAP (ciągłe dodatnie ciśnienie powietrza) zmniejsza wrażliwość receptora leptyny. Długotrwałe całkowite pozbawienie snu obniża poziom leptyny.
Ghrelina: Odgrywa rolę w regulacji bilansu energetycznego i stymuluje apetyt. Poziom greliny wzrasta gwałtownie przed każdym stałym posiłkiem i osiąga punkt szczytowy 1-2 godziny po jedzeniu. Mimo że głód nie ustępuje, poziom greliny nie wzrasta przez cały sen, lecz obniża się w późniejszych godzinach snu. Przy wysokim poziomie podczas snu jest ona silnym endogennym stymulatorem wydzielania GH .
Neuropeptyd Y (NPY): NPY jest szeroko rozpowszechniony w podwzgórzu, amygdale, locus coeruleus i korze mózgowej. Zdefiniowano co najmniej sześć podtypów receptorów dla NPY. NPY odgrywa rolę w przyjmowaniu pokarmu, wydzielaniu hormonów, rytmach okołodobowych, reakcji na stres, lęku i funkcji snu. U zwierząt, w zależności od miejsca wstrzyknięcia, stwierdzono, że NPY ma działanie zarówno promujące sen, jak i pobudzające. Uważa się, że u ludzi NPY ma właściwości hipnotyczne i działa jako fizjologiczny antagonista CRH. NPY bierze udział w określaniu czasu rozpoczęcia snu u ludzi i w związku z tym może odgrywać rolę w integracji regulacji snu, przyjmowania pokarmu i metabolizmu .
Współtransmitery autonomicznego układu nerwowego (neuropeptydy)
Jądra zlokalizowane w podwzgórzu (w tylnej i bocznej części znajdują się jądra współczulne, w przedniej części – przywspółczulne) kontrolują autonomiczny układ nerwowy. Wraz z podwzgórzem i strukturami limbicznymi, współczulne i przywspółczulne części autonomicznego układu nerwowego regulują wegetatywne zachowania sensoryczne i motywacyjne. Głównym przekaźnikiem dla układu współczulnego (katecholaminergicznego) jest noradrenalina (noradrenalina), a neuropeptyd Y działa jako kotransmiter. W łożyskach naczyniowych zakończenia adrenergiczne wydzielają NPY razem z noradrenaliną. Sam NPY ma działanie wazokonstrykcyjne. Acetylocholina (Ach) jest głównym przekaźnikiem układu przywspółczulnego (cholinergicznego), a VIP (wazoaktywny peptyd jelitowy) działa jako kotransmiter tego układu. W śliniankach i gruczołach potowych, w układzie płciowym i rdzeniach nadnerczy zakończenia cholinergiczne wydzielają VIP wraz z ACh. VIP wywiera częściowe działanie rozszerzające naczynia krwionośne i silne działanie rozszerzające oskrzela .
Hormon koncentrujący melaninę (MCH)
MCH jest cyklicznym neuropeptydem o długości 19 aminokwasów, działającym jako neuroprzekaźnik. Neurony zawierające MCH znajdują się głównie w bocznych częściach podwzgórza i w okolicach podwzgórza, a ich projekcje w obrębie mózgu są bardzo rozległe. U ludzi funkcje biologiczne tego neuropeptydu są realizowane za pośrednictwem dwóch receptorów metabotropowych, mianowicie MCHR1 i MCHR2, podczas gdy u gryzoni występuje tylko MCHR1.
Ogólne funkcje w organizmie:
1) Zachowania związane z odżywianiem się i oszczędzaniem energii; wysokie stężenie MCH może prowadzić do zwiększonego spożycia i wiąże się ze wzrostem masy ciała. Przeciwnie, obniżenie istniejącego poziomu MCH może prowadzić do zmniejszenia ilości spożywanych pokarmów. Zwiększone stężenie MCH w regionach węchowych jest związane ze spożywaniem tłustych produktów o wysokiej kaloryczności. Dobre w smaku produkty spożywcze promują MCH, zachęcając do ich większego spożycia. Cukier, a szczególnie glukoza, wydaje się wspierać rolę MCH w utrzymaniu snu i energii. Takie wspieranie oszczędzania energii wiąże się z wysoką masą ciała, nawet jeśli dieta jest pod kontrolą.
2) Umieszczanie MCH w określonych miejscach tylko w okresie laktacji wydaje się wspomagać zachowania macierzyńskie.
3) Reprodukcja: Zakłada się, że MCH działa jako modulator wydzielania hormonu luteinizującego (LH) poprzez bezpośredni wpływ na przysadkę mózgową lub poprzez pośredni wpływ na hormon uwalniający gonadotropiny (GNRH) w podwzgórzu. Estrogen wydaje się być niezbędny, aby MCH mógł wpływać na reprodukcję.
4) Pigmentacja skóry: MCHR1 został znaleziony w ludzkich melanocytach i niektórych komórkach czerniaka. W tych komórkach wykazuje on antagonistyczny związek z α-MSH i zmniejsza produkcję melaniny. Specyficzna regulacja zachowania podczas snu: Jeśli chodzi o cykl snu, MCH i oreksyna pozostają ze sobą w relacji antagonistycznej, oreksyna jest prawie całkowicie aktywna w okresach czuwania, a MCH jest bardziej aktywna. Neurony MCHergiczne są bardziej aktywne podczas snu, szczególnie podczas snu REM; chociaż zwiększają one również SWS, to głównie wydłużają czas trwania snu REM. Myszy pozbawione MCH mają krótszy sen REM, zwłaszcza w warunkach ujemnego bilansu energetycznego. Antagoniści MCHR1 podawani ogólnoustrojowo zmniejszają sen. Chociaż MCH promuje sen, istnieje ograniczona liczba badań wiążących MCH z narkolepsją. Narkolepsja od dawna jest opisywana jako zaburzenie mechanizmu snu REM. Osoba cierpiąca na narkolepsję zaczyna spać snem REM. Narkolepsja objawia się utratą komórek podwzgórza, które zawierają hipokretynę i oreksynę. W jednym z badań wykazano, że u osób cierpiących na narkolepsję występuje zmniejszenie liczby neuronów oreksyny, które promują czuwanie, a liczba neuronów MCH nie różni się od liczby neuronów u przeciętnej osoby, która nie cierpi na narkolepsję. MCH ma związek z depresją i lękiem. Wykazano, że antagoniści MCHR1 działają jak leki przeciwdepresyjne. Chemokiny i cytokiny pojawiają się zwykle w wyniku zapalenia lub infekcji i mogą uszkadzać neurony MCH, powodując tym samym anoreksję u danej osoby. MCH zidentyfikowano zarówno w liniach komórkowych czerniaka, jak i raka kolczystokomórkowego.
Przegląd (ogólne spojrzenie na neurofarmakologię związaną ze snem)
Układ i cząsteczki odpowiedzialne za regulację snu i czuwania modulują ogólne mechanizmy homeostatyczne, a także regulują czynności poznawcze, takie jak uwaga, uczenie się i pamięć. Musimy opracować ogólną perspektywę dla substancji farmakologicznych wpływających na te czynności.
Alkohol
Alkohol etylowy; blokuje receptory glutaminianowe NMDA i jest pośrednim agonistą receptorów GABA. Mózgowe komórki ziarniste zwiększają transmisję GABAergiczną w korze móżdżku i hipokampie. Alkohol jest neurotoksyczny w dużych dawkach; może w szczególności hamować przekaźnictwo cholinergiczne, które dociera do kory mózgowej za pośrednictwem neuronów podstawnego przodomózgowia. Może to prowadzić do znacznego pogorszenia sprawności ruchowej i może powodować zaburzenia snu. Mogą wystąpić problemy behawioralne wynikające z niedoboru snu, a także problemy z pamięcią u alkoholików z powodu widocznego wpływu alkoholu na hipokamp. Osoby z niezdiagnozowaną schizofrenią, zaburzeniami lękowymi i depresją mogą próbować korzystać z uspokajającego i anksjolitycznego działania alkoholu poprzez jego nadmierne spożycie. U tych osób pogarsza się ukrwienie okolic czołowych i upośledzona jest zdolność podejmowania decyzji .
Środki znieczulające, uspokajające i hipnotyczne
Główne mechanizmy działania środków farmakologicznych wywołujących sen są nadal przedmiotem badań.
Głównym miejscem działania większości środków znieczulających może być układ kontroli snu i czuwania. W anestezji, biorąc pod uwagę fakt, że pobudzenie i czujność stanowią kontinuum poziomów od manii do śpiączki, z towarzyszącymi czynnikami fizjologicznymi i behawioralnymi, monitorowanie EEG, wraz z objawami behawioralnymi i autonomicznymi, powinno być rutynowo stosowane do oceny poziomu znieczulenia.
Większość anestetyków, w tym barbiturany, etomid, propofol, steroidy neuroaktywne i lotne środki znieczulające, działa między innymi na receptory GABAa. Sedacja i naturalny sen występują w znacznym stopniu w wyniku nasilenia przekaźnictwa GABAergicznego, co z kolei wpływa na uwalnianie szeregu przekaźników pobudzających, takich jak acetylocholina, aminokwasy pobudzające i histamina. Działanie może mieć miejsce szczególnie w takich regionach, jak RAS, TMN i przodomózgowie podstawne (wszystkie te regiony mają lokalne obwody neuronów GABAergicznych i otrzymują GABAergiczny sygnał wejściowy z VLPO, jak opisano wcześniej), regulując w ten sposób poziom pobudzenia. Benzodiazepiny działają poprzez wiązanie się z miejscem, które moduluje receptory GABA, zwłaszcza receptory GABAa. Środki te wykazują działanie uspokajające, hipnotyczne, anksjolityczne i przeciwdrgawkowe. Ich działanie polega na wzmacnianiu przekaźnictwa GABAergicznego, tak że środki krótko działające były stosowane w celu ułatwienia zasypiania u pacjentów cierpiących na bezsenność, chociaż ostatnio opracowano skuteczne hipnotyzujące leki niebenzodiazepinowe. Środki te również ułatwiają funkcjonowanie receptorów GABAa (np. zolpidem i zaleplon). Bezsenność jest bardzo częstym objawem, zwłaszcza u osób starszych, i ma wiele przyczyn, w tym fizycznych, społecznych i psychiatrycznych.
Leki przeciwdepresyjne o działaniu uspokajającym (trójpierścieniowe leki przeciwdepresyjne, trazadon, nefazadon i mitrazapina) wywierają swój wpływ na stan emocjonalny za pośrednictwem receptorów noradrenergicznych (NE) 5-HT, a ich działanie uspokajające obserwuje się poprzez antagonizm receptorów H1, 5-HT2, alfa1.
Leki stosowane w leczeniu bezsenności (melatonina i analogi melatoniny) wywierają swoje działanie za pośrednictwem receptorów MT1 i MT2.
Inne substancje hipnotyczne działające poprzez GABA (preparaty waleriany, Gabapentyna, Tiagabina), uspokajające leki przeciwpsychotyczne (Olanzapina, kwetiapina; są antagonistami 5HT-2A), Gamma-hydroksymaślan (jego mechanizm działania nie jest do końca poznany, uważa się, że moduluje aktywność dopaminergiczną; jest zalecany w narkolepsji w leczeniu katapleksji) .
Leki przeciwhistaminowe
Projekcje histaminergiczne w jądrze tuberomilnym są aktywne podczas czuwania. Patologia tego obszaru prowadzi do hipersomnii. Wejścia histaminergiczne z TMN do RAS hamują SWS, ale nie mają wpływu na REM. W RAS, przodomózgowiu podstawnym, bocznym podwzgórzu i korze mózgowej występują duże ilości receptorów histaminowych. Działanie leków przeciwhistaminowych (blokerów receptorów histaminowych) na te regiony powoduje zawroty głowy, senność i zaburzenia funkcji poznawczych. U dzieci leki przeciwhistaminowe pierwszej i drugiej generacji mogą powodować zatrucia i śpiączkę, jednak nowsze preparaty pediatryczne (trzeciej generacji) (np. feksofenadyna, loratadyna, cetyryzyna) wydają się bezpieczniejsze .
Kofeina
Popularność kofeiny wynika z jej właściwości pobudzających. Blokuje ona receptory adenozynowe w układzie RAS, zmniejsza działanie hamujące adenozyny, przez co zwiększa się poziom wolnej adenozyny w mózgu, co powoduje działanie pobudzające w OUN. Kofeina wydaje się blokować receptory adenozyny A1 i A2a, wywołując efekt pobudzenia psychoruchowego. Ze względu na wysoki poziom receptorów A2a w prążkowiu rozważa się potencjalne zastosowanie kofeiny w leczeniu choroby Parkinsona. Ponieważ blokada receptorów adenozyny A2a wydaje się chronić neurony dopaminergiczne przed czynnikami toksycznymi, zaproponowano neuroprotekcyjną rolę kofeiny w leczeniu choroby Parkinsona. Przyjmowanie kofeiny wiąże się również ze zmniejszonym ryzykiem wystąpienia choroby Alzheimera, co prawdopodobnie działa jako czynnik neuroprotekcyjny .
Nikotyna
Jest to alkaloid występujący w dużych ilościach w tytoniu i bakłażanach. Jest metabolizowana w wątrobie, a jej głównym metabolitem jest kotynina. Podczas palenia nikotyna w małych dawkach wywiera wpływ na układ współczulny (tachykardia, wysokie ciśnienie krwi) i przywspółczulny (tonus w układzie pokarmowym, wzrost ruchów perystaltycznych i wydzielania kwasu). (zwiększenie stężenia tromboksanu A2, lipoliza, pobudzenie psychoruchowe, zmniejszenie apetytu, działanie przeciwbólowe, zwiększenie wydzielania ADH, ACTH, kortyzolu i insuliny, zmniejszenie wydzielania LH i PRL). Powoduje uzależnienie psychiczne i fizyczne. Wiadomo, że nikotyna zawarta we wdychanym dymie papierosowym przenika do płuc, skąd ponad 80% dostępnej nikotyny jest wchłaniane do krwiobiegu. Po wchłonięciu do krwi, nikotyna łatwo przekracza barierę krew-mózg i wydaje się być szybko wydzielana do tkanki mózgowej. Stężenia nikotyny w mózgu są 5-7 razy wyższe niż stężenia we krwi. Palacze twierdzą, że oprócz pozytywnego wpływu na koncentrację i uwagę, głównym pozytywnym efektem palenia jest uspokajanie i relaks. Ostatnie odkrycia sugerują, że jednym z miejsc działania nikotyny może być układ RAS, a konkretnie neurony PPN. Nikotyna, przynajmniej początkowo, działa hamująco na cholinergiczne neurony RAS, co może wywoływać efekt uspokajający odnotowywany po inhalacji dymu papierosowego. Większość papierosów jest palona przez osoby chore psychicznie, zwłaszcza z zaburzeniami związanymi z nadwrażliwością lub hiperpobudliwością, takimi jak schizofrenia, zaburzenia lękowe i depresja. Oznacza to, że palenie może być formą samoleczenia, prawdopodobnie ze względu na swoje działanie uspokajające. Ten efekt (hamowanie neuronów cholinergicznych RAS) wydaje się różnić od roli palenia w zmniejszaniu częstości występowania choroby Parkinsona, która wydaje się przejawiać jako neuroprotekcyjne działanie nikotyny na neurony dopaminergiczne. Rozszerzenie naczyń mózgowych jest widoczne bezpośrednio po paleniu, ale u przewlekłych palaczy obserwuje się globalne zmniejszenie mózgowego przepływu krwi. Biorąc pod uwagę, że w schizofrenii, zaburzeniach lękowych i depresji występuje hipofrontalność, po początkowym korzystnym, uspokajającym działaniu nikotyny może nastąpić pogorszenie korowego przepływu krwi. Taki efekt może wywoływać głód sięgnięcia po kolejnego papierosa, tworząc błędne koło ciągłego samopodawania .
Środki pobudzające
Najpowszechniej stosowana substancja stymulująca, amfetamina, indukuje uwalnianie monoamin, zwłaszcza dopaminy, ale także blokuje ich wychwyt zwrotny i może mieć działanie neurotoksyczne na neurony nigralne, a ostatnio podejrzewa się, że wywołuje degenerację niektórych neuronów prążkowia. Niestety, środek ten jest nadużywany w celach rekreacyjnych i nadal przepisuje się go w leczeniu zaburzeń uwagi (ADD). Na szczęście metylofenidat nie wydaje się mieć tak neurotoksycznego działania, chociaż jego stosowanie jest coraz rzadsze.
Stymulanty nieamfetaminowe: Modafinil – został wyprodukowany specjalnie do leczenia narkolepsji. Modafinil jest nowszym środkiem pobudzającym, który nie wydaje się działać poprzez mechanizmy dopaminergiczne, jak amfetamina. Wydaje się, że modafinil wpływa na struktury zaangażowane w regulację stanu czuwania i snu oraz na szereg układów przekaźnikowych, w tym noradrenergicznych, histaminergicznych i oreksynergicznych, a także na uwalnianie aminokwasów pobudzających i serotoniny. Ponadto może blokować receptory GABAa .
Schizofrenia, zaburzenia lękowe i depresja
Hipofrontalność, nadwrażliwość i zaburzenia snu są częstymi objawami tych zaburzeń. Regiony związane z RAS (cholinergicznym PPN, noradrenergicznym LC i serotoninergicznym RN), które do tej pory próbowaliśmy omówić, ich neuroprzekaźniki i środki farmakologiczne działające na ich receptory są wykorzystywane w leczeniu tych objawów. Wiadomo, że serotoninergiczna RN hamuje PPN i LC, przy czym cholinergiczna PPN pobudza LC, a noradrenergiczna LC hamuje, poprzez receptory adrenergiczne alfa-2, PPN. PPN wysyła pobudzające projekcje cholinergiczne do istoty czarnej (substantia nigra, SN), która z kolei wysyła projekcje dopaminergiczne do striatum. W leczeniu depresji stosowano wcześniej trójpierścieniowe leki przeciwdepresyjne, takie jak amitryptylina, imipramina i klomipramina, które głównie blokowały wychwyt zwrotny noradrenaliny i serotoniny oraz hamowały uwalnianie histaminy i acetylocholiny, co było przyczyną zwiększonej senności. Selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) działają bardziej wybiórczo na układ RAS poprzez zwiększenie hamowania. Nie jest jasne, czy etiologia depresji jest związana z hamowaniem PPN i LC przez obniżenie napięcia serotoninergicznego, chociaż wydaje się to prawdopodobnym źródłem symptomatologii sen-czuwanie w depresji. W leczeniu zaburzeń lękowych stosuje się benzodiazepiny, które wzmacniają hamowanie GABAergiczne. Ponadto stosowanie agonisty receptorów noradrenergicznych alfa-2, klonidyny, wywołuje efekt anksjolityczny, prawdopodobnie poprzez hamowanie autoreceptorów w LC i receptorów postsynaptycznych w PPN, co powoduje zmniejszenie czujności. Ze względu na obwodowe działanie klonidyny na układ sercowo-naczyniowy bardziej pożądane byłoby stosowanie agonistów receptorów adrenergicznych alfa-2, którzy nie wykazują takiego działania. Jedno z badań dostarczyło mocnych dowodów na stosowanie agonisty receptorów adrenergicznych alfa-2, deksmedetomidyny, jako leku anksjolitycznego w leczeniu zaburzeń lękowych, takich jak zespół stresu pourazowego, napady paniki i zaburzenia lękowe ogólne . Proponuje się, aby etiologia zaburzeń lękowych wiązała się z obniżeniem lub zwyrodnieniem wyjścia LC (prawdopodobnie wywołanym przez hormony stresu), co mogłoby spowodować uwolnienie lub zahamowanie neuronów PPN w miejscu ich działania.
Sugeruje się, że etiologia schizofrenii obejmuje zwiększoną produkcję PPN, co jest przyczyną znacznej nadwrażliwości i halucynacji. Nadmierne wydzielanie PPN mogłoby nadmiernie aktywować SN i z kolei zwiększać prążkowe uwalnianie dopaminy, co jest zgodne z dopaminergiczną teorią schizofrenii. SWS są obniżone u schizofreników. Zgodnie z tym założeniem, niższe SWA odnotowywano częściej u pacjentów leczonych instytucjonalnie, z głębokimi zaburzeniami poznawczymi, a także u chorych na schizofrenię z wyraźnymi objawami negatywnymi. W leczeniu schizofrenii stosowano wcześniej haloperidol, bloker receptorów dopaminergicznych, który powodował m.in. dyskinezy tardywne i inne poważne działania niepożądane. Nowsze leki przeciwpsychotyczne, takie jak risperidon i kwetiapina, wydają się blokować receptory dopaminergiczne, noradrenergiczne i serotoninergiczne. Bardziej uderzające efekty przeciwpsychotyczne uzyskano, stosując klozapinę, która została zaprojektowana jako muskarynowy bloker receptorów cholinergicznych w leczeniu choroby Parkinsona .
Choroby zwyrodnieniowe narządów ruchu i nieruchowe (stwardnienie zanikowe boczne, choroba Parkinsona)
ALS jest nieuleczalną chorobą neurodegeneracyjną górnych i dolnych neuronów ruchowych, która charakteryzuje się zwyrodnieniem dróg korowo-rdzeniowych, co prowadzi do utraty neuronów ruchowych w mózgu, pniu mózgu i komórkach rogów przednich rdzenia kręgowego. Utrata neuronów ruchowych w pniu mózgu i rdzeniu kręgowym powoduje osłabienie mięśni gardła, krtani, mięśni międzyżebrowych i przepony. Podczas snu non-REM napięcie mięśniowe jest obniżone, a podczas snu REM napięcie mięśniowe jest prawie całkowicie utracone. Automatyczna wentylacja podczas snu jest prawie całkowicie zależna od przepony (szczególnie w fazie REM), dlatego zaburzenia funkcji przepony (takie jak w ALS) mogą predysponować do hipowentylacji i nocnej hipoksemii. Choroba Parkinsona [PD] jest drugim co do częstości występowania schorzeniem neurodegeneracyjnym po chorobie Alzheimera. Do rozwoju PD dochodzi w wyniku przewlekłego, postępującego obniżenia stężenia dopaminy w istocie czarnej, wtórnego do utraty neuronów dopaminergicznych w pars compacta i pojawienia się ciał Lewy’ego w cytoplazmie pozostałych neuronów. Choroba jest rozpoznawana głównie klinicznie, a pacjenci mogą mieć charakterystyczne deficyty ruchowe, do których należą drżenie spoczynkowe, bradykinezja, sztywność i niestabilność postawy. Jednak u większości pacjentów występują zarówno objawy ruchowe, jak i niemotoryczne. Objawy niemotoryczne powodują zaburzenia snu, nastroju, poznania, czucia i funkcji autonomicznych. Wśród objawów niemotorycznych w PD zaburzenia snu występują z drugą co do częstości częstością po zaburzeniach neuropsychiatrycznych.
Funkcje analityczne cząsteczek wpływających na sen w neurofizjologii i fizjopatologii
Należy zwrócić szczególną uwagę na stan hormonalny. W końcu pierwszą oznaką dojrzewania jest pulsacyjne uwalnianie hormonu (LH) podczas snu. Na przykład narkolepsja jest ściśle związana z pewnymi haplotypami ludzkiego antygenu leukocytów (HLA), co sugeruje, że jest to zaburzenie autoimmunologiczne. Omawiany wcześniej zespół Kleina i Levina jest związany z podobnymi haplotypami, co sugeruje etiologię autoimmunologiczną. Co ciekawe, w większości przypadków narkolepsji, zespołu Kleina-Levina, a także schizofrenii, napadów paniki, zaburzeń obsesyjno-kompulsywnych i innych zaburzeń, początek choroby przypada wkrótce po okresie dojrzewania. Z drugiej strony, u około 20% pacjentów ze schizofrenią matka miała atak grypy w drugim trymestrze ciąży, podczas gdy narkoleptycy rodzą się głównie późną zimą i wczesną wiosną, czyli po sezonie grypowym. Sugeruje się, że dysregulacje rozwojowe, zarówno przed-, jak i okołoporodowe (początkowy uraz), stają się patologicznie widoczne po okresie dojrzewania i związanej z nim napaści hormonalnej. Rozważania te wskazują na złożone interakcje między rozwojem, środowiskiem i stanem hormonalnym, które w nieznany dotąd sposób wpływają na regulację snu i czuwania. Wyniki te sugerują, że wpływ hormonów, zarówno tych przepisywanych na receptę lub przyjmowanych w postaci suplementów diety, jak i nadużywanych, wymaga dokładniejszego zbadania i uwzględnienia w projektowaniu interwencji terapeutycznych .
Zapotrzebowanie mózgu na energię jest wyjątkowo duże; wszelkie zmiany w wykorzystaniu glukozy przez mózg mogą mieć istotny wpływ na tolerancję glukozy. Wykorzystanie glukozy przez mózg jest mniejsze podczas SWS niż podczas snu REM lub czuwania. Za pomocą skanów PET wykazano silną korelację między aktywnością wolnofalową, wskaźnikiem intensywności SWS, a regionalnym przepływem krwi w mózgu przedczołowym. Ponadto badania eksperymentalne, polegające na ciągłym żywieniu dojelitowym lub dożylnym wlewie glukozy przy jednoczesnym umożliwieniu normalnego snu nocnego, wykazały, że tolerancja glukozy jest minimalna w pierwszej połowie okresu snu, tj. w czasie, gdy SWS jest dominującą fazą snu. Wyniki te potwierdzają istnienie silnego związku między SWS a tolerancją glukozy. Zarówno skrócenie całkowitego czasu trwania snu przy w znacznym stopniu zachowanym śnie wolnofalowym (SWS), jak i zmiany jakości snu (zwłaszcza znaczne skrócenie SWS) przy zachowaniu całkowitego czasu trwania snu wiążą się z insulinoopornością bez kompensacyjnego zwiększenia wydzielania insuliny, co skutkuje upośledzoną tolerancją glukozy i zwiększonym ryzykiem cukrzycy typu 2. Ograniczenie snu, przeprowadzane w ściśle kontrolowanych warunkach spożycia energii i aktywności fizycznej, wiąże się również ze zmniejszeniem stężenia leptyny (hormonu anoreksygennego) i zwiększeniem stężenia greliny (hormonu oreksygennego), głodu i apetytu. Co więcej, ograniczenie snu wiąże się również ze stymulacją regionów mózgu wrażliwych na bodźce związane z jedzeniem, co wskazuje, że utrata snu może prowadzić do otyłości poprzez wybór wysokokalorycznych pokarmów. Istnieją również dowody na to, że ograniczenie snu może stanowić sprzyjające środowisko dla aktywacji genów sprzyjających otyłości.
Dziedziczność wskaźnika masy ciała jest zwiększona u osób śpiących krótko. Tak więc przewlekłe ograniczanie snu, które jest coraz częstsze we współczesnym społeczeństwie, w tym u dzieci, prawdopodobnie przyczynia się do obecnej epidemii cukrzycy typu 2 i otyłości .
Przewlekła utrata snu jest coraz bardziej powszechna w społeczeństwach uprzemysłowionych i dotyka około 45% dorosłych. Niedobór snu wywołuje zmiany behawioralne, hormonalne i neurochemiczne. Stres nieodłącznie związany z brakiem snu powoduje zmiany w stężeniu hormonów, takich jak kortyzol, a także prolaktyna i estradiol, które, jak wiadomo, wpływają na przekaźnictwo dopaminergiczne.
Badania sugerują, że dopamina (DA) jest odpowiedzialna za zmiany behawioralne obserwowane po deprywacji snu. Wykazano, że deprywacja snu REM jest związana ze zmianami we wrażliwości receptorów postsynaptycznych D2 w striatum szczura. Myszy pozbawione transportera DA (DAT) wykazują zwiększony poziom czuwania i mniejszy SWS. Sen REM może indukować wzrost aktywności dopaminergicznej po deprywacji snu, a selektywna deprywacja snu REM przez dłuższy czas może prowadzić do obniżenia regulacji DAT, zwiększając neurotransmisję dopaminergiczną. Pochodne amfetaminy hamują wychwyt zwrotny DA pośredniczony przez DAT .
Krótkotrwała deprywacja snu wykazuje właściwości terapeutyczne w przypadku zaburzeń nastroju, natomiast długotrwała/przewlekła deprywacja i zaburzenia snu są związane z rozwojem zaburzeń nastroju poprzez dysregulację aktywności monoamin (5-HT, NE, DA). Główne objawy depresji wynikają z funkcjonalnego niedoboru mózgowych przekaźników monoaminergicznych: noradrenaliny, serotoniny i/lub dopaminy, podczas gdy mania jest spowodowana funkcjonalnym nadmiarem monoamin w krytycznych synapsach w mózgu. Chociaż ostatnio niektóre obserwacje podważyły zasadność tej teorii, dysregulację wytwarzania i przekazywania monoamin nadal uważa się za ważny czynnik w regulacji nastroju, emocji, poznania, zachowań motywacyjnych i reakcji na stres. Deuschle i wsp. przeprowadzili badania w grupie osób cierpiących na przewlekłą bezsenność i stwierdzili, że krótki allel transportera 5-HT występował istotnie częściej u pacjentów cierpiących na bezsenność niż u osób dobrze śpiących. Roman i wsp. sugerują, że przewlekłe ograniczenie snu może zwiększać podatność jednostki na rozwój zaburzeń nastroju poprzez upośledzenie przekaźnictwa serotoninergicznego w wyniku aktywacji układu stresowego. Wykazano również, że skład genetyczny układu dopaminergicznego, który jest zaangażowany w podatność na zaburzenia nastroju, jest związany z reakcją na utratę snu i zmianami w reakcji na nagrodę u ludzi. Polimorfizm w receptorze dopaminowym 2, a częściej w systemie transportera dopaminy, jest związany z podatnością na zaburzenia psychiczne w przypadku niedoboru snu u ludzi. Powszechnie wykazano, że osoby cierpiące na bezsenność wykazują hiperaktywację osi podwzgórze-przysadka-nadnercza zarówno na poziomie mózgu, jak i na poziomie obwodowym. Zwiększenie stężenia noradrenaliny, epinefryny i innych markerów wypływu współczulnego jest związane z pobudzeniem poznawczym i emocjonalnym oraz nadwrażliwością somatyczną u osób cierpiących na bezsenność: jest to kluczowy mechanizm patofizjologiczny bezsenności. Zmiany obserwowane w strukturach mózgu u osób cierpiących na bezsenność obejmują zmniejszenie objętości kory przedczołowej, głowy ogoniastej i hipokampa, a także zwiększenie objętości jądra migdałowatego, co przypomina zmiany opisywane u osób cierpiących na zaburzenia nastroju. Biorąc pod uwagę te podobieństwa, wysunięto hipotezę, że bezsenność może wpływać na rozwój i utrzymanie zaburzeń nastroju poprzez aktywację systemu stresu i jego negatywnych konsekwencji dla mózgu, w tym neurogenezy hipokampa, plastyczności synaptycznej i łączności .
Wreszcie, można mówić o związku między snem a lekami przeciwdepresyjnymi, które działają na układy aktywności monoamin (5-HT, NE, DA) w mózgu:
1) Trójpierścieniowe leki przeciwdepresyjne (TCA) (antagoniści receptorów 5HT-1, NE, M1, H1);
a) trzeciorzędowe TCA skracają latencję snu i zmniejszają liczbę przebudzeń podczas snu. Dlatego postrzegane są jako leki uspokajające; doksepina i amitryptylina zmniejszają częstość REM w EEG snu, powodują wydłużenie latencji snu REM,
b) drugorzędowe TCA, takie jak desipramina, są mniej sedatywne i względnie stymulujące, c) silne serotoninergiczne TCA, takie jak klomipramina, zwiększają ruchy gałek ocznych w NREM. Nasila ona okresowe ruchy kończyn podczas snu,
2) niespecyficzne inhibitory wychwytu zwrotnego (5HT, NE DA); trazadon działa sedatywnie, a nefazodon mniej sedatywnie, nasilają one sen SWS,
3) inhibitory monoaminooksydazy (MAOI) (np. tranylcypromina, moklobemid),
4) selektywne inhibitory wychwytu zwrotnego serotoniny SSRI (np. fluoksetyna, escitalopram, paroksetyna, sertralina),
5) inhibitory wychwytu zwrotnego serotoniny i noradrenaliny (SNRI) (np, wenlafaksyna, duloksetyna, reboksetyna)
6) bupropion (hamowanie wychwytu zwrotnego noradrenaliny i dopaminy) środki te zwiększają SWS, wydłużają latencję REM, skracają czas REM,
7) agomelatyna (agonizm na receptorach melatoninowych M1 i M2, antagonizm na receptorach serotoninergicznych 5-HT2C), stwierdzono, że zwiększa SWS .
Im więcej dowiemy się o neurofizjologii snu i działaniu powiązanych z nim cząsteczek, tym lepiej zrozumiemy procesy patologiczne zachodzące w stanie czuwania. Zrozumienie funkcjonowania mózgu w czasie snu, wraz z neuroprzekaźnikami, hormonami i nowymi cząsteczkami, pozwoli wyjaśnić nieznane procesy fizjologiczne i zainspiruje innowacyjne procesy w farmakologii.
Autor: Murat Kayabekir
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny














Więcej
Czy ludzie agresywni powinni być izolowani i co się dzieje z ich mózgiem?
Czy Polsce grozi epidemia Ćpunów?
Ci ludzie są tak głupi a może tak mądrzy albo chorzy?