
Ostatnia aktualizacja 28 lipca 2022
Zaparcie to jedna z najczęstszych dolegliwości układu pokarmowego, które dotyka pacjentów w każdym wieku. Czynniki środowiskowe, osobiste i genetyczne mogą wpływać na zaparcia.
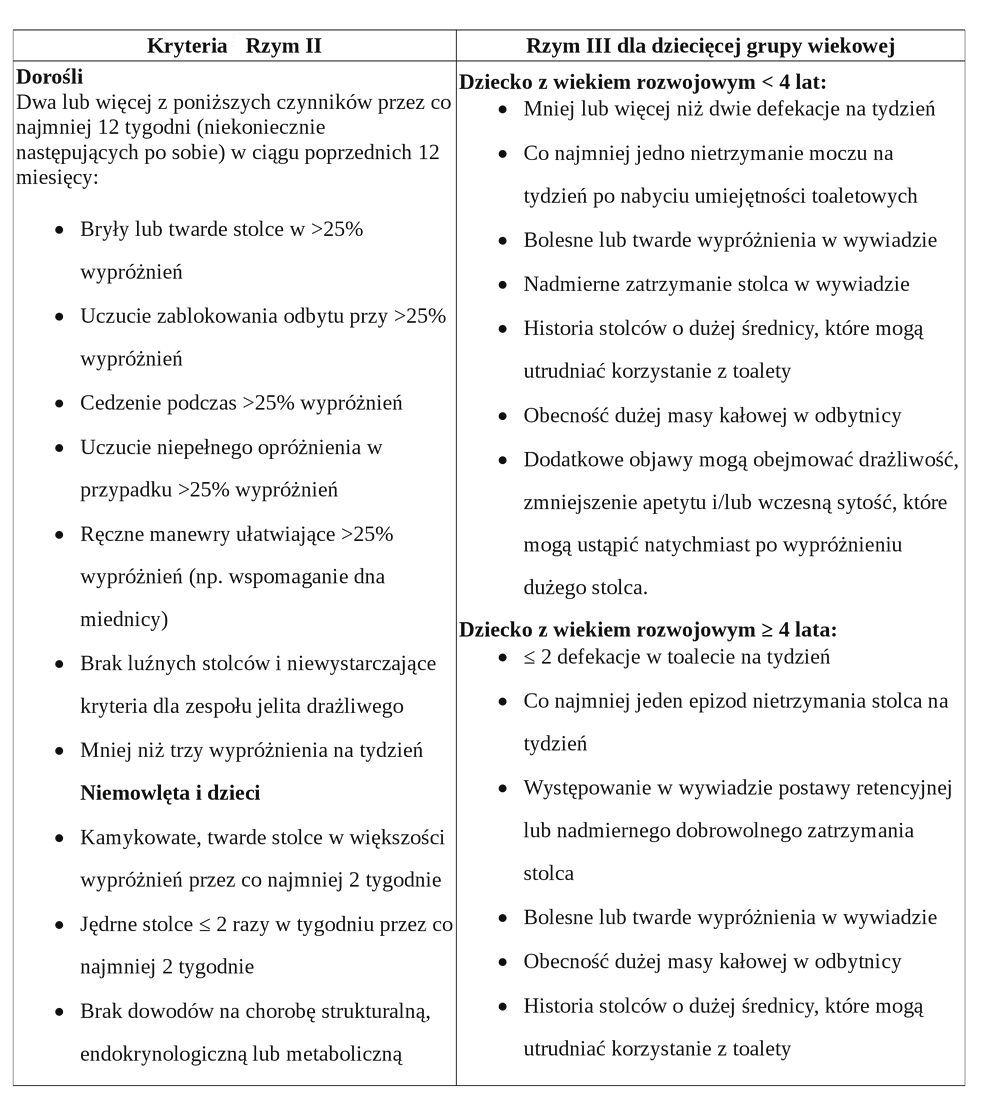
Zaparcie jest szeroko definiowane jako problem z wypróżnianiem, charakteryzujący się rzadkimi stolcami, utrudnionym oddawaniem stolca lub jednym i drugim. Powszechne podejście do patofizjologii zaparć dzieli to zaburzenie na przyczyny pierwotne i wtórne. Pierwotnymi przyczynami są wewnętrzne problemy funkcji okrężnicy lub odbytu, natomiast wtórne związane są z chorobami organicznymi, chorobami ogólnoustrojowymi lub lekami.
Opracowano również definicję zaparcia według Kryteriów Rzymskich tj. klasyfikacji zaburzeń czynnościowych przewodu pokarmowego (Tabela 1).
Pierwszym krokiem w postępowaniu z pacjentem z zaparciami jest dokładne zrozumienie natury dolegliwości.
- Czy pojawiła się ona niedawno?
- Jaka jest częstotliwość i forma stolców oraz ile wysiłku wymaga wypróżnienie?
- Czy zaparcie jest stałe czy zmienne jak w zespole jelita drażliwego?
- Czy istnieją strukturalne, metaboliczne lub farmakologiczne czynniki zakłócające?
- Czy pacjent ma depresję a może długotrwały stres?
- Czy próbowano stosować błonnik pokarmowy w wystarczającej dawce?
- Jakie są wyobrażenia i przekonania pacjenta na temat objawów?
- Czy przeprowadzono wystarczające i odpowiednie badania?
- Jaki styl życia pacjent prowadzi czynny czy bierny?

Uzbrojeni w odpowiedzi na te pytania, lekarze mogą pomóc większości pacjentów poprzez dostosowanie stylu życia, diety i farmakologii, wraz z uzupełnieniem błonnika. Niektórzy pacjenci mogą wymagać regularnych dawek osmotycznego środka przeczyszczającego. Ci nieliczni, którzy zawiodą te środki, powinni mieć oszacowany czas przejścia podczas stosowania diety wysokobłonnikowej; jeśli jest on normalny, dalsze badania raczej nie pomogą. Należy ponownie podkreślić powyższe wysiłki i zaoferować uspokojenie. Niektórzy pacjenci mogą wymagać oceny psychologicznej. Jeśli czas tranzytu treści pokarmowej jest wydłużony, a pacjent może odnieść korzyść z leczenia operacyjnego bezwładności okrężnicy lub biofeedbacku (biologiczne sprzężenie zwrotne, np.:EEG,EMG,GSR,HEG,HRV,RSA inne) w przypadku anismusu, należy ocenić czynność okrężnicy i odbytu. Decyzja o wykonaniu dalszych badań powinna być podjęta ostrożnie, a nierealistyczne oczekiwania powinny być wykluczone. Przed zaproponowaniem operacji pacjent powinien mieć możliwość uzyskania opinii eksperta.
W większości przypadków zaparcia są wieloczynnikowe. Można je podzielić na trzy szerokie kategorie:
- zaparcia o normalnym przejściu,
- zaparcie o powolnym przejściu i
- zaburzenia defekacji.
Do powstania zaparć u pacjenta może przyczyniać się więcej niż jeden mechanizm.
Zaparcia o prawidłowym tranzycie treści pokarmowej są prawdopodobnie spowodowane postrzeganymi trudnościami z wypróżnianiami lub obecnością twardych stolców. Stolec przechodzi z normalną szybkością w okrężnicy i reaguje na leki modyfikowane dietą. Dysfunkcja dna miednicy lub zwieracza odbytu często prowadzi do zaburzeń wypróżniania. Nieskuteczne opróżnianie odbytnicy może wynikać z niemożności koordynacji mięśni brzucha, odbytu i dna miednicy podczas defekacji.
Zaparcie o powolnym tranzycie występuje najczęściej u młodych kobiet z rzadkim wypróżnianiem, które występuje w wyniku bezwładności okrężnicy i nadaktywności okrężnicy, głównie z powodu zmniejszonej aktywności okrężnicy i zwiększonej, nieskoordynowanej aktywności okrężnicy.
Innym podtypem, który występuje z powodu prawidłowego lub przedłużonego tranzytu jelitowego, jest lekkie zaburzenie wypróżniania, ale wydalanie stolca z odbytnicy jest niewystarczające, trudne. Powiązane objawy to rzadka potrzeba wypróżnienia, wzdęcia oraz ból lub dyskomfort w jamie brzusznej. Objawy zaparcia zwykle odpowiadają na terapię samym błonnikiem pokarmowym lub dodatkiem osmotycznego środka przeczyszczającego. Istnieje szereg czynników prowadzących do stanu zaparć, które zostały wymienione poniżej.
Czynniki przyczynowe zaparć
- Stany chirurgiczne: guz jelita grubego i ucisk z guza zewnętrznego, uchyłkowatość, szczelina odbytu, zwężenia, rozdęcie okrężnicy i nieprawidłowości pooperacyjne
- Choroby metaboliczne: cukrzyca, hiperkalcemia, hipokaliemia, hipomagnezemia, hipermagnezemia, nadczynność przytarczyc, niedoczynność tarczycy, przewlekła choroba nerek, odwodnienie, zatrucie metalami ciężkimi, mnogie nowotwory endokrynologiczne II i porfiria
- Choroby żołądkowo-jelitowe: ropień, szczelina odbytu, zespół jelita drażliwego przetoki, hemoroidy, zespół dźwigacza odbytu, rozdęcie okrężnicy, ból odbytnicy, wypadanie odbytnicy, odbytnica i skręt
- Zaburzenia mięśniowo-szkieletowe: twardzina, twardzina układowa, amyloidoza i zapalenie skórno-mięśniowe
- Dieta: tłuste (smalec) i kleiste (mąka woda cukier) potrawy, zaburzenia odżywiania, odwodnienie i niska zawartość błonnika
- Stres, depresja i demencja
- Leki
- Inne: choroba zwyrodnieniowa stawów, unieruchomienie, choroba serca, ciąża i nietrzymanie moczu
Leki związane z zaparciami
Stwierdzono, że wiele grup leków jest silnie skorelowanych z zaparciami, najwięcej w przypadku blokerów kanału wapniowego, a najmniej w przypadku leków przeciwarytmicznych (Tabela 2).

Zaparcie jest zasadniczo stanem subiektywnym.
Dlatego najważniejsze narzędzie do diagnozowania zaparć zależy głównie od historii klinicznej. Oznaki i objawy wspólne dla zaparć zarówno w dzieciństwie, jak iw wieku dorosłym to nieregularna czynność jelit z nadmiernymi wzdęciami o nieprzyjemnym zapachu i stolce o nieregularnej teksturze. Czasami pacjenci mogą zgłaszać się z historią przepuszczania małych granulek lub rzadszą dużą ilością stolców i bolesnym wypróżnianiem. Wstrzymywanie lub napinanie stolców, zabrudzenia lub przelewanie. Wzdęcie brzucha lub dyskomfort, zmniejszony apetyt, łatwa męczliwość i drażliwy nastrój to kilka innych objawów.
Diagnoza i podejścia diagnostyczne
Rozpoznanie zależy głównie od wywiadu klinicznego wspomaganego badaniem radiologicznym i badaniem krwi w celu wykluczenia chorób podstawowych: dokładny wywiad i badanie fizykalne mogą wykluczyć większość wtórnych przyczyn zaparcia.
Etapy oceny stanu
Wywiad kliniczny i badanie fizykalne
Ocena kryteriów klinicznych, obecność czynników ryzyka oraz identyfikacja niepokojących cech wskazują na konieczność wykonania kolonoskopii i/lub badania radiologicznego w celu wykluczenia przyczyn wtórnych. Badanie palcowe odbytnicy i badanie proktologiczne mogą pomóc w identyfikacji chirurgicznych przyczyn zaparć. U każdego pacjenta z zaparciami należy przeprowadzić dokładne badanie przez odbyt, które często jest najbardziej ujawniającą częścią oceny klinicznej. W różnych badaniach opracowano szereg kryteriów oceny zaparć, które zostały zatwierdzone w praktyce klinicznej, jak pokazano poniżej.
Klasyczne kryteria
Zaparcia u dziecka definiuje się, gdy występują co najmniej dwa z następujących kryteriów:
Co najmniej dwa epizody nietrzymania moczu w tygodniu
Częstotliwość defekacji mniej niż 3 razy w tygodniu
Okresowe oddawanie bardzo dużych ilości stolca raz na 7–30 dni (kryterium dużej ilości stolca jest spełnione, jeśli szacuje się, że jest to dwukrotność standardowej ilości stolca, pokazanej na modelu glinianym, lub jeżeli stolce są tak duże że zapychają toaletę).
Inna terminologia zaparcia
Przewlekłe zaparcia są spowodowane wystąpieniem dwóch lub więcej z następujących cech w ciągu ostatnich 8 tygodni:
Mniej niż trzy wypróżnienia tygodniowo
Więcej niż jeden epizod nietrzymania stolca na tydzień
Duże stolce w odbytnicy lub wyczuwalne palpacyjnie w badaniu jamy brzusznej
Przejście stolców o dużej średnicy, które mogą blokować toaletę
Bolesna defekacja
Badania
Badania kałowe, radiologiczne lub endoskopowe nie są rutynowo wskazane w przypadku braku ciężkich objawów. Sigmoidoskopia jest zwykle wystarczająca u pacjentów bez nasilonych objawów oraz u osób poniżej 50 roku życia. Dorośli w wieku powyżej 50 lat mają prawo do kolonoskopii lub zarówno sigmoidoskopii, jak i badania z wlewem barowym w celu wykluczenia raka jelita grubego.
Badania krwi
Zaburzenia równowagi elektrolitowej, zaburzenia metaboliczne, zaburzenia endokrynologiczne i inwazję parazytologiczną można wykluczyć za pomocą badania krwi. Badania te należy zlecać głównie w przypadkach podejrzanych klinicznie.
Defekografia baru
Defekografia baru to test rentgenowski, w którym gęstą pastę zawierającą bar umieszcza się w odbytnicy. Określa, czy na dnie miednicy występują jakieś nieprawidłowości. Zaleca się identyfikację chorób jelita grubego (choroba uchyłkowa, neoplazja, rozdęcie okrężnicy).
Manometria anorektalna
Ten test mierzy ciśnienie w kanale odbytu, gdy pacjent naciska podczas wypróżniania. Ten test jest zalecany w przypadkach opornych na leczenie. Głównym celem jest wykluczenie chorób takich jak aganlionoza i psychogenne rozdęcie okrężnicy. Dostarcza informacji o odruchu hamującym odbytniczo-odbytniczym, napięciu mięśniowym zwieraczy wewnętrznych i zewnętrznych oraz wrażliwości, pojemności i samozadowoleniu odbytnicy.
Wideodefekografia, defekografia rezonansem magnetycznym lub echodefekografia
Wideodefekografia to radiologiczne badanie dynamiki wypróżniania. Jest przydatny w badaniu nieprawidłowości, takich jak odbytnica, wgłobienie, enterocele, sigmoidocele, odbyt i paradoksalny skurcz mięśnia łonowo-odbytniczego. Ostatnie publikacje sugerują, że wideo defekografia wykorzystująca wyłącznie zapis wideo bez radiografii ze względu na wysoką ekspozycję na promieniowanie, podczas gdy inni wybrali defekografię rezonansu magnetycznego lub echodefekografię, bez użycia promieniowania jonizującego.
Badanie czasu przejścia (tranzytu) przez jelito grube (CTT)
Kapsułka zawierająca nieprzepuszczalne dla promieni rentgenowskich markery jest połykana i 5 dni później wykonywany jest radiografia jamy brzusznej. Dzięki temu można dokonać identyfikacji trzech typów wzorców u pacjentów; w normalnym czasie przejścia pacjenci eliminują 80% markerów do piątego dnia. W powolnym tranzycie ponad 20% markerów jest zatrzymywanych do piątego dnia, rozprowadzane w jelicie grubym, a u osób z niedrożnością jelit zatrzymują ponad 20% markerów piątego dnia, które pozostają nagromadzone w okolicy odbytniczo-sigmoidalnej. Chociaż jest to test nieinwazyjny, narażenie na promieniowanie występuje nawet w małych dawkach. CTT może być zalecane do oceny skuteczności klinicznego lub chirurgicznego leczenia przewlekłych zaparć.
Test wydalenia balonu
Balon wypełniony wodą (50-60 ml) umieszcza się w bańce odbytnicy. Jeśli wydalenie zostanie osiągnięte przez pacjenta, dysfunkcja dna miednicy może zostać wykluczona. Jest zalecany w wielu wytycznych dotyczących oceny zaparć.
Elektromiografia zwieracza odbytu
W kanale odbytu umieszcza się małe czujniki elektryczne, które rejestrują aktywność elektryczną mięśni zwieraczy podczas zamierzonych skurczów, w spoczynku oraz przy kaszlu i wysiłku wypróżniania.
Test oddechowy wodorowy
Jest zalecany do oceny czasu tranzytu ustno-kątniczego. Pomaga odróżnić zaburzenia motoryki przewodu pokarmowego (górnego i dolnego) od izolowanej bezwładności okrężnicy. Jest zalecany w ciężkich i opornych przypadkach bezwładności okrężnicy, przed wskazaniem do kolektomii. Podobnie w różnych badaniach opracowano szereg kryteriów oceny zaparć.
Leczenie zaparć
Modyfikacje stylu życia
Stwierdzono, że odwodnienie i zmniejszenie aktywności fizycznej zwiększają stan zaparć, dlatego różne badania zalecają odpowiednie nawodnienie i zwiększenie aktywności fizycznej.
Stwierdzono, że dieta bogata w błonnik jest korzystna w przypadku zaparć. Idealna ilość to 25–35 g dziennie. Błonnik zwiększa objętość stolca i sprawia, że wypróżnienia stają się miękkie lub jędrne. Aby poprawić przestrzeganie zaleceń, należy poinstruować pacjentów, aby stopniowo zwiększali spożycie błonnika pokarmowego do 20–25 g dziennie przez okres 1–2 tygodni. Jeśli to podejście nie jest skuteczne, należy wypróbować komercyjnie pakowane suplementy błonnika. Regularne nawyki jelit, ostrożne stosowanie środków przeczyszczających i kontrola leków, w tym dawkowanie i czas, są również skuteczne w zaparciach.
Leki powszechnie stosowane na zaparcia
Środki przeczyszczające
Masowy środek przeczyszczający
Leki stosowane w zaparciach wymieniono poniżej w kolejności.
Psyllium (Metamucil, Perdiem i Fiberall)
Błonnik naturalny należy popijać dużą ilością wody, aby uniknąć niedrożności jelit; reakcje alergiczne, takie jak anafilaksja i astma, są rzadkie; miareczkować do 20 g.
Metyloceluloza (Cytrucel)
Półsyntetyczne włókno celulozowe, które jest stosunkowo odporne na rozkład bakteryjny okrężnicy; miareczkować do 20 g
Polikarbofil (FiberCon, Equalactin i Konsyl)
Włókno syntetyczne z polimeru kwasu akrylowego, odporne na degradację bakteryjną; miareczkować do 20 g
Osmotyczny środek przeczyszczający
To wciąga wodę do jelit wzdłuż gradientu osmotycznego.
Wodorotlenek magnezu (Mleko magnezowe Phillipsa); 15-30 ml raz lub dwa razy.
Cytrynian Magnezu (Evac-Q-Mag); 150–300 ml w razie potrzeby.
Fosforan sodu (Fleet Enema, Fleet Phospho-Soda, Visicol); 10-25 ml z 12 oz. (360 ml) wody w razie potrzeby.
Słabo przyswajalny cukier
Laktuloza (Cephulac, Chronulac i Duphalac);
Syntetyczny disacharyd; 15-30 ml raz lub dwa razy dziennie.
Pobudzający środek przeczyszczający
Stymuluje ruchliwość jelit lub wydzielanie.
Antrachinony.
Cascara sagrada (Coleman, Sagrada-lax): 325 mg (lub 5 ml) dziennie.
Senna (Senokot, Ex-Lax): 187 mg dziennie.
Olej rycynowy (Purge, Neoloid, Emulsoil):15-30 ml dziennie.
Bisakodyl (Dulcolax, Correctol): 5–10 mg co noc.
Pikosiarczan sodu (Lubrilax, Sur-Lax): 5-15 mg co noc.
Rozmiękczacz stolca
Dokuzan sodu (Colace, Regulax SS, Surfak): 100 mg dwa razy dziennie.
Olej mineralny (Flotowy Olej Mineralny): 5–15 ml doustnie każdego wieczoru.
Lewatywa fosforanowa (Fleet Enema): 120 ml dziennie.
Lewatywa zatrzymująca olej mineralny (Fleet Mineral Oil Enema): 100 ml dziennie.
Lewatywa z wody kranowej: 500 ml dziennie.
Lewatywa mydlana: 1500 ml dziennie.
Czopek bisakodylu glicerynowego: 10 mg na dobę.
Środek cholinergiczny
Bethanechol (Urecholina): 10 mg dziennie.
Inne leki
Kolchicyna (kolsalid): 0,6 mg trzy razy dziennie.
Mizoprostol (Cytotec): 600–2400 μg na dobę.
Środek prokinetyczny
Tegaserod to środek prokinetyczny okrężnicy, który poprawia konsystencję i częstotliwość stolca u kobiet z zespołem jelita drażliwego charakteryzującym się zaparciami.
Agoniści receptora 5-HT4 Cisapride (Propulsid): 10–20 mg cztery razy dziennie.
Tegaserod (Zelnorm): 6 mg dwa razy dziennie.
Pojawiające się leki w leczeniu schorzeń zaparć
Velusetrag i Naronapride (agoniści receptora 5-HT4), Pumosetrag (agonista receptora 5-HT3) i kilka innych leków, takich jak plekanatyd (sekretagog okrężnicy), metylonaltrekson (antagonista receptora opioidowego), elobixibat (sekretagog prokinetyczny) i alwimopan (antagonista receptora opioidowego), linaklotyd, elobixibat, naldemedina to nieliczne leki stosowane w leczeniu zaparć.
Postępowanie chirurgiczne
Pacjenci, którzy nie odnoszą korzyści z leczenia zachowawczego i bez niedrożności jelit, mogą odnieść korzyści z subtotalnej kolektomii z zespoleniem krętniczo-odbytniczym. Oporne zaparcia mogą mieć dobre wyniki po całkowitej resekcji okrężnicy i ileorektotomii u pacjenta bez zaburzeń wypróżniania. W systematycznym przeglądzie 32 badań potwierdzono zadowalające wyniki po kolektomii w zakresie od 39 do 100% pacjentów. Zgłoszono niewiele powikłań, takich jak biegunka, nietrzymanie moczu i niedrożność jelit. Podobnie w niektórych badaniach wykazano, że laparoskopowa kolektomia subtotalna była równie skuteczna u osób, które nadawały się do resekcji okrężnicy.
Inne środki
Biofeedback
Jest to leczenie zachowawcze. Pacjenci są szkoleni w zakresie fizjologicznych mechanizmów defekacji. Podkreśla się wykorzystanie ich przepony oraz mięśni brzucha i dna miednicy do wypróżniania. Podawany jest również trening sensoryczny. Pacjenci otrzymują odpowiedź słuchową lub wzrokową, lub obie, na funkcjonowanie i koordynację ich mięśni zwieracza odbytu i dna miednicy. Sztuczny stolec wypełniony balonem lub silikonem, który jest również określany jako „wolność”, może być używany jako biofeedback z większym naciskiem na normalną koordynację w celu udanej defekacji. Edukacja pacjentów i dobre relacje między lekarzem a pacjentami są kluczem do udanego biofeedbacku. Różne badania dotyczące leczenia biofeedbackiem wykazały ogólny wskaźnik powodzenia wynoszący 67%. Niemniej jednak nadal brakuje odpowiednich danych dotyczących skutecznej praktyki biofeedbacku.
Masaż brzucha
Według różnych badań, masaż brzucha ma pozytywny wpływ na zaparcia.
Toksyna botulinowa typu A
Wstrzyknięcie toksyny botulinowej typu A do mięśnia łonowo-odbytniczego może być korzystne w leczeniu zaburzeń wypróżniania ujawnionych w niektórych badaniach. Jednak do tej pory nie przeprowadzono żadnych kontrolowanych badań, więc ta metoda nie jest sugerowana.
Probiotyki
Probiotyki, zwłaszcza Bifidobacterium lactis, mają pozytywny wpływ na skrócenie ogólnego i regionalnego czasu tranzytu jelitowego, zwiększenie częstotliwości oddawania stolca oraz poprawę jego konsystencji. Po podaniu myszom z zaparciem Bifidobacterium adolescentis CCFM 669 i 667 względna liczebność bakterii z rodzaju Lactobacillus wzrosła, a względna liczebność Clostridia zmniejszyła się. B. adolescentis CCFM 669 i 667 łagodziły objawy zaparcia poprzez zwiększenie stężenia kwasu masłowego i propionowego oraz przyleganie komórek nabłonka jelitowego. Lactobacillus reuteri łagodził przewlekłe zaparcia poprzez znaczne zmniejszenie produkcji CH4. Dimidi E i wsp. stwierdzili również, że modyfikacja środowiska luminalnego jelita za pomocą określonych szczepów probiotycznych może wpływać na ruchliwość i wydzielanie jelitowe, przynosząc tym samym korzyści pacjentom z zaparciami. Zmiana ruchu jelit poprzez regulację biosyntezy serotoniny może być jednym z mechanizmów, dzięki którym mikrobiota jelitowa poprawiała zaparcia. Ponadto probiotyki mogłyby złagodzić zaparcia i poprawić inne objawy spowodowane zaparciami. Na przykład probiotyki chroniły zdrowie neuronów poprzez aktywację ścieżki sygnalizacyjnej kinazy białkowej, łagodząc w ten sposób depresję spowodowaną zaparciami.
Jednak prosta suplementacja probiotyków niekoniecznie zmienia mikrobiom śluzówki jelit człowieka. Człowiek ma specyficzną oporność na kolonizację błony śluzowej jelit na probiotyki, a osobisty mikrobiom i cechy gospodarza są różne wśród różnych osób.
Dlatego zdolność kolonizacji probiotyków w błonie śluzowej jelita wykazuje różnice osobnicze. Skuteczność probiotyków w przypadku zaparć nie została określona. Indywidualne różnice w charakterystyce mikrobiomu jelitowego mogą wpływać na działanie probiotyków.
Prebiotyki
Prebiotyki to składniki żywności stosowane w celu pobudzenia mikrobioty w przewodzie pokarmowym, a ich głównym źródłem w diecie są grzyby, owies, jęczmień, wodorosty i inne pokarmy bogate w błonnik. Warto zauważyć, że prebiotyki mogą selektywnie stymulować wzrost i aktywność korzystnych bakterii, a stymulacja ta może stanowić istotny mechanizm łagodzenia zaparć. Huang P i wsp. leczyli pacjentki z zaparciami poporodowymi laktulozą i stwierdzili, że poprawa w zakresie objawów zaparcia była istotnie lepsza niż w grupie kontrolnej, m.in. wydłużenie czasu remisji, wydłużenie dni wolnych od zaparcia oraz skrócenie czasu defekacji. Wspólny rodzaj jadalnych alg morskich Enteromorpha zawierających bogate węglowodany, białka, błonnik surowy i witaminy oraz polisacharydy z rzepaku wykorzystano do ingerencji w zaparcia, a następnie stwierdzono, że odwracają one stan zapalny jelit i przywracają ich funkcję. Jako prebiotyk, fruktan typu inuliny wykazał selektywny wpływ na ludzką mikrobiotę jelitową, zwłaszcza bifidobakterie, bakterie beztlenowe i Bilophila, oraz poprawił związane z zaparciami metryki jakości życia. Podobnie glukomannan Konjac, jako bioaktywny błonnik pokarmowy, również zapewniał liczne korzyści zdrowotne, takie jak kontrolowanie otyłości i masy ciała, korzyści prebiotyczne, łagodzenie zaparć, zmniejszanie stanu zapalnego spowodowanego chorobami związanymi z jelitami, równoważenie mikrobioty jelitowej, modulator układu odpornościowego i zmniejszanie ryzyka raka jelita grubego.
Synbiotyki
Synbiotyki to czynniki biologiczne stosowane w połączeniu z probiotykami i prebiotykami, charakteryzujące się jednoczesnym działaniem probiotyków i prebiotyków. Przyjmowanie synbiotyków może skutecznie regulować mikrobiotę jelitową i poprawiać częstotliwość oddawania stolca, jego konsystencję oraz objawy związane z zaparciami. Ponadto, synbiotyki składające się z fruktooligosacharydu i probiotyków były stosowane do interwencji u pacjentów z zaparciami i również osiągnęły podobne wyniki. Coraz więcej dowodów wskazywało, że zarówno probiotyki, jak i prebiotyki mogą zwiększać odporność organizmu na patogeny i wpływać na układ odpornościowy organizmu.
Synbiotyki mogą łączyć działanie probiotyków i prebiotyków w celu poprawy mikrobioty jelitowej, środowiska jelitowego i perystaltyki jelit oraz promowania wydzielania jelitowego, ale wszystkie związane z tym badania nie przyniosły pożądanych rezultatów. Badano wpływ suplementu synbiotyków (połączenie BB12, LP01 i inuliny-oligofruktozy) na objawy zaparcia czynnościowego wśród odpowiednich osób. Częstość defekacji i rodzaj stolca w grupie leczonej uległy znacznej poprawie w porównaniu z grupą placebo, ale różnice w ewakuacji stolca nie były istotne i synbiotyki nie wykazały korzyści w stosunku do kontroli ze względu na wysoki efekt placebo. Efekt synergistyczny probiotyków i prebiotyków w synbiotykach nie został w pełni wykazany. Dlatego też rzeczywista rola synbiotyków w mikrobiocie jelitowej związanej z zaparciami wymaga dalszych badań opartych na lepszym projekcie naukowym i większych próbach.
Transplantacja mikrobioty kałowej – skuteczność i bariery w zaparciach czynnościowych
Zaparcie czynnościowe (ZC) jest częstym schorzeniem, które byłoby trudne do leczenia w praktyce klinicznej, a występuje powszechnie w populacji. Farmakoterapia jest powszechnie stosowaną metodą leczenia. Jednak efekty kliniczne są ograniczone i pacjenci nadal cierpią na tę przypadłość. W ostatnich latach, wraz ze stopniowym wzrostem badań nad mikrobiotą jelitową, zrozumiano, że dysbioza mikrobioty jelitowej jest istotnie związana z rozwojem zaparć. Ostatnie badania wykazały, że transplantacja mikrobioty kałowej (PMK) jest skuteczną metodą odbudowy mikrobioty jelitowej, jak również jest skuteczna w leczeniu ZC. W niniejszym mini przeglądzie przedstawiono charakterystykę mikrobioty jelitowej u pacjentów z ZC, mechanizm działania PMK, sposoby leczenia, aktualną skuteczność i związane z tym zagadnienia. Celem jest przedstawienie kierunków badań i odniesień dla przyszłych zastosowań PMK w ZC.
Zaparcie czynnościowe (ZC) jest jednym z częściej występujących schorzeń i stanowi formę przewlekłego zaparcia. Pacjenci mogą odczuwać trudności w wypróżnianiu, uczucie niepełnej defekacji, zmniejszoną częstość wypróżnień oraz suche, twarde stolce, z przewagą pacjentów w podeszłym wieku i kobiet. Dokładna patogeneza choroby nie jest jeszcze jasna, co utrudnia jej leczenie, a nawroty objawów mają poważny wpływ na jakość życia danej osoby.
W leczeniu zaparć pacjenci często wybierają doustne środki przeczyszczające; chociaż mogą one szybko złagodzić objawy zaparcia, długotrwałe stosowanie może łatwo doprowadzić do zaburzenia równowagi flory jelitowej, a nawet do uszkodzenia funkcji nerwów jelitowych i mięśni gładkich, przez co wrażliwość jelit ulegnie zmniejszeniu, a po odstawieniu leku objawy zaparcia będą gorsze niż wcześniej.
Konieczne jest zatem znalezienie bezpiecznego i skutecznego środka do leczenia ZC.
W ostatnich latach udział środków mikroekologicznych doprowadził do lepszego zrozumienia ZC i flory jelitowej oraz do wyprowadzenia wschodzącej terapii mikroekologicznej, przeszczepu mikrobioty kałowej (PMK), poprzez przywrócenie wewnętrznej równowagi mikroekologicznej jelit.
PMK zapewnia nowatorskie rozwiązanie dla chorób w przewodzie pokarmowym i poza nim poprzez rygorystyczne badanie źródeł kału zdrowych dawców i przeszczepianie funkcjonalnej flory ze zdrowego ludzkiego kału do jelita pacjenta, regulując w ten sposób wzór dystrybucji flory w świetle jelita i tym samym przywracając mikroekosystem jelitowy do normy.
W ostatnich badaniach stwierdzono, że PMK ma rolę w leczeniu ZC, ale obecnie istnieją duże różnice w raportowaniu między ośrodkami badawczymi, całkowita liczba badanych przypadków jest niewielka, a stosowane kryteria techniczne nieco się różnią
Poniżej przeczytasz przegląd charakterystyki flory jelitowej pacjentów z ZC, mechanizmu działania PMK, sposobów leczenia i aktualnego stanu skuteczności, uwzględniając doniesienia literaturowe związane z PMK w leczeniu ZC, w celu stworzenia odniesienia dla wystandaryzowanego klinicznego zastosowania PMK w leczeniu ZC.
Charakterystyka mikrobioty jelitowej u pacjentów z ZC
W porównaniu z osobami zdrowymi, u pacjentów z ZC stwierdzono istotne różnice w liczbie i składzie strukturalnym flory jelitowej. Określenie zmieniającej się charakterystyki mikrobioty jelitowej u pacjentów z ZC jest warunkiem koniecznym do precyzyjnego leczenia PMK.
Zoppi i wsp. wykonali posiewy bakterii ze stolca u dzieci z ZC i stwierdzili istotny wzrost liczby Bifidobacterium. Natomiast hodowla bakteryjna (Khalif i wsp. ) oraz detekcja Rt-PCR (Kim i wsp. ) kału od dorosłych pacjentów z ZC wykazały istotne zmniejszenie liczebności Bifidobacterium.
Analiza flory jelitowej starszych pacjentów z ZC wskazała na istotny wzrost liczby Bifidobacterium. Wobec powyższych sprzeczności w ustaleniach dotyczących bifidobakterii, z jednej strony podkreśla się, że choć nie ma wątpliwości, że bifidobakterie są obecnie stosowane jako probiotyki dla organizmu człowieka, mogą regulować florę jelitową, hamować stan zapalny i regulować szlaki metaboliczne poprzez trzy mechanizmy kontrolujące występowanie ZC.
Jednak należy również uznać, że pacjenci ZC w różnym wieku mogą mieć unikalne cechy flory jelitowej, więc zastosowanie PMK powinno zwrócić uwagę na klasyfikację grup wiekowych. Z drugiej strony, ujawniono również, że wczesne badania w większości wykorzystywały mikroskopię bezpośrednio do oceny standardowych kultur bakterii poprzez selektywne hodowle, którym brakowało powtarzalności i nie mogły wykryć żywych i martwych mikroorganizmów w próbkach kału, a także występowały błędy w określaniu flory jelitowej; tymczasem tradycyjne testy biologii molekularnej zmniejszyły obiektywność wyników ze względu na ich niską przepustowość. Dlatego też wraz z rozwojem nowoczesnej makrogenomiki, w oznaczaniu mikrobioty jelitowej dominuje obecnie 16S rRNA.
Zhu i wsp. po raz pierwszy wykorzystali 16S rRNA do badania flory jelitowej dzieci z ZC i stwierdzili znaczny spadek liczby Prevotella oraz tendencję wzrostową azylu gruboskorupowego. Wykazano, że Prevotella odgrywa kluczową rolę w rozwoju i leczeniu zaparć, więc spadek jej liczebności jest prawdopodobnie związany z ZC. Mancabelli i wsp. wykazali, że we florze jelitowej pacjentów z ZC występowało znaczne zmniejszenie liczby Bacillus spp, Rhodobacter spp i Faecaloccus spp. W powyższych badaniach wnioskowano głównie o składzie mikrobioty jelitowej poprzez badanie mikroflory kału, w którym brakowało uwagi na mikroflorę błony śluzowej jelita. Dlatego Parthasarathy i wsp. zebrali próbki mikrobioty śluzówki i kału z okrężnicy esowatej pacjentek z przewlekłym zaparciem, ocenili je za pomocą sekwencjonowania genu 16S rRNA i stwierdzili, że Bacteroidetes były bardziej obfite w mikrobiotę śluzówki jelita grubego u pacjentek z zaparciem. Zauważono również, że flora jelitowa pacjentów z zaparciami ma unikalną mikrobiotę zarówno na błonie śluzowej jelita grubego, jak i w kale, gdzie na błonę śluzową jelita grubego nie ma wpływu dieta i transport jelita grubego, natomiast bakterie kałowe są zaburzone przez transport jelita grubego, ale nie są związane z zaparciami. Tak więc flora jelitowa pacjentów z ZC ma unikalną mikrobiotę zarówno na błonie śluzowej jelita grubego, jak i w kale, gdzie na błonę śluzową jelita grubego nie ma wpływu dieta i transport jelita grubego, natomiast bakterie kałowe są zaburzone przez transport jelita grubego, ale nie są związane z zaparciami. Może to być jedna z przyczyn stosowania tych samych metod badawczych ze sprzecznymi wynikami.
Ponadto czynniki środowiskowe, nawyki żywieniowe, leki i dynamika jelit mogą być potencjalnymi czynnikami wpływającymi na skład flory jelitowej pacjentów z ZC Cechy kału również wpływają na rozmieszczenie flory jelitowej, a badania wykazały, że bogactwo gatunkowe jest dodatnio skorelowane z zawartością wody w kale i ujemnie z twardością kału. Jednak brak jednolitości gatunków flory pochodzącej z obecnych badań ogranicza porównywalność, a obecne oznaczenie 16S rRNA może dotyczyć tylko taksonomii bakterii na poziomie rodzaju i wyższym. Dlatego też przesiewanie w kierunku bardziej podobnych grup badawczych i opracowanie bardziej wyrafinowanych kryteriów badania są konieczne, aby poprawić dokładność wyników flory jelitowej u pacjentów z ZC i zapewnić bardziej ukierunkowane leczenie przy zastosowaniu PMK.
Mechanizm działania PMK w ZC
Zbiorowiska drobnoustrojów występują na powierzchni ciała ludzkiego oraz w świetle zewnętrznym, przy czym największą ich gęstość stwierdza się w jelicie dystalnym, gdzie znacznie przekraczają całkowitą liczbę komórek w organizmie. W rzeczywistości uważa się, że dystalna flora jelitowa pełni wiele funkcji fizjologicznych, w tym metabolizm energetyczny, rozwój układu odpornościowego i regulację różnych narządów ciała. W ostatnich badaniach wykazano, że struktura flory jelitowej jest nieprawidłowa u pacjentów z zaparciami, przy czym z jednej strony obserwuje się znaczny wzrost liczby bakterii potencjalnie patogennych (bakterie tlenowe, Escherichia coli, grzyby) w stolcu, a z drugiej strony znaczny spadek liczby flory dominującej (bakterie beztlenowe, bifidobakterie, bakterie anafilaktyczne). Zaburzenia flory jelitowej mogą być zaangażowane w rozwój i progresję ZC poprzez różne ścieżki, w tym układ nerwowy i metabolity flory jelitowej. 5-Hydroksytryptamina jest neuroprzekaźnikiem na osi mózg-jelita-bakterie, a Bifidobacterium bifidum indukuje wzrost wydzielania 5-hydroksytryptaminy. Metabolity flory jelitowej przyspieszają przekaźnictwo jelita grubego poprzez promowanie wydzielania 5-hydroksytryptaminy; pacjenci ZC z obniżoną florą dominującą nie mogą skutecznie promować wydzielania 5-hydroksytryptaminy, co powoduje zaparcia.
PMK przeszczepia zdrową ludzką florę jelitową do jelita pacjenta odpowiednią drogą w celu odbudowy mikroekologii mikrobioty jelitowej, normalizacji składu i funkcji mikrobioty jelitowej, regulacji odporności błony śluzowej jelit i funkcji bariery jelitowej oraz przywrócenia dynamiki jelit, łagodząc tym samym objawy związane z zaparciami. Ponadto podanie PMK poprzez kolonoskopię szybko wywołało mikrobiologiczną normalizację struktury społeczności, a jej flora jelitowa 24 h po podaniu była bardzo podobna do składu dawcy.
Postępowanie w przypadku PMK
Źródło bakterii kałowych
Wybór źródła kału jest wynikiem dwukierunkowej selekcji dawcy i biorcy, a standaryzowane badania przesiewowe próbek kału dawcy mogą zagwarantować bezpieczeństwo transplantacji biorcy, natomiast wyjaśnienie zmienionej flory jelitowej biorcy może zapewnić trafność wyboru dawcy. Po pierwsze, źródło bakterii kałowych jest obecnie wybierane spośród członków rodziny, przyjaciół lub standaryzowanych banków bakterii kałowych. W przypadku długoterminowych dawców kału wyraźnie proponuje się przeprowadzenie nowej rundy badań przesiewowych w wieku 8-12 tygodni, a nawet podkreśla się znaczenie diety, ćwiczeń fizycznych i zarządzania zdrowiem dawców podczas cyklu transplantacyjnego w celu zmniejszenia zakłóceń próbek kału przez zewnętrzne niepewności, co zapewnia w pewnym stopniu bezpieczeństwo źródła kału i zmniejsza potencjalne czynniki wpływające na skład flory. Po drugie, przechowywanie źródeł kału ukształtowało się obecnie jako standaryzowany proces, który wymaga zakończenia przygotowania w ciągu 6 h od oddania i przechowywania w lodówce o temperaturze -80°C przez okres przechowywania nie dłuższy niż 6 miesięcy. Wreszcie, przeszczepienie źródła kału, czy pochodzi ono od tego samego dawcy, jest niejasne. Cele przeszczepu PMK to zmniejszenie interferencji różnych źródeł kału z wynikiem, uniknięcie odrzucenia przeszczepu przez biorcę i promowanie rekonstytucji flory jelitowej u pacjentów ZC.
Tak więc dwukierunkowe dopasowanie dawca-akceptant można obecnie pogrupować na 2 modele w następujący sposób:
Jeden do jednego (jeden podmiot dla jednego dawcy), chociaż model ten wyjaśnia korespondencję, czy po wielokrotnych przeszczepach następuje szybkie wysycenie pewnej flory u biorcy, pozostawiając inne korzystne bakterie jeszcze nie w optymalnej liczbie możliwość zatrzymania skuteczności występującej z powodu tego, że inne korzystne bakterie nie osiągnęły jeszcze optymalnej liczby.
Jeden do wielu (jeden podmiot odpowiada wielu dawcom), z możliwością odrzucenia kolonizacji między korzystnymi bakteriami i osłabieniem skuteczności występującym, gdy źródła kału od różnych dawców są przeszczepiane do jelita biorcy. Wynika z tego, że w wielokrotnych sesjach przeszczepu PMK można dodać dodatkowe pary stałe jeden do jednego lub pary losowe jeden do wielu, aby zawęzić czynniki wpływające, które prowadzą do osłabienia skuteczności.
Metoda implantacji bakterii kałowych
Implantacja bakterii kałowych odbywa się głównie przez 3 moduły przewodu pokarmowego: górny, środkowy i dolny. W analizie skuteczności próby leczenia pacjentów z ZC różnymi drogami podania (kapsułka doustna, sonda nosowo-żołądkowa, kolonoskopia) sugerowano, że różnice między grupami były istotne statystycznie. Nie ma jednak wystarczających dowodów, aby potwierdzić, że jeden sposób podawania jest najwłaściwszy, a ponadto istnieją dwie strony każdej jednej metody podawania. Istnieją dwie strony każdej metody podawania. Górna droga przewodu pokarmowego jest zdominowana przez zgłębnik nosowo-żołądkowy, kapsułki doustne jako droga dominująca, których obecność utrudnia zapewnienie całkowitego pokrycia płynem kałowym całego przewodu pokarmowego, zwiększając potencjał do przerostu bakterii w jelicie cienkim. Jednocześnie umieszczenie rurki nosowo-żołądkowej może łatwo wywołać u badanych niekomfortowe reakcje, takie jak wymioty, którym towarzyszy zwiększone ryzyko aspiracji. Obecnie preferuje się stosowanie kapsułek doustnych ze względu na ich prostotę i wygodę, co w znacznym stopniu pozwala uniknąć dyskomfortu związanego z ingerencją instrumentalną. Jednak ze względu na rygorystyczny i kosztowny proces przygotowania i przechowywania, ekonomika stanowi wyzwanie, a preparaty PPI często wymagają zmniejszenia stężenia kwasu żołądkowego, aby uniknąć uszkodzenia skuteczności i stabilności kapsułek. Droga dolnego odcinka przewodu pokarmowego jest bardziej znana jako lewatywa i kolonoskopia. Lewatywy polegają na odwrotnym przepływie płynu kałowego do okrężnicy i są najczęściej ograniczone do zgięcia śledzionowego okrężnicy i kolejnych segmentów.
Kolonoskopia pozwala na bardziej równomierne rozprowadzenie płynu kałowego w całym przewodzie jelitowym wraz z procesem perystaltycznym, ale ze względu na inwazyjny charakter zabiegu istnieje ryzyko perforacji jelita, a u niektórych pacjentów przemijającej biegunki. Podsumowując, najwłaściwszy schemat powinien być wybrany po indywidualnej ocenie przestrzegania zaleceń i tolerancji przez pacjenta.
Aktualny stan skuteczności PMK
Częstotliwość transplantacji
Częstość migracji PMK u pacjentów z ZC w większości badań badano na 2 sposoby:
Pojedynczy cykl transplantacji: głównym modelem jest cykl leczenia 1 raz/d przez 3 dni. Tian i wsp. w badaniu pacjentów z ZC leczonych PMK, z całkowitą spontaniczną defekacją ≥ 3 razy jako kryterium wskaźnika remisji klinicznej, monitorowali zmiany w 1, 2 i 4 tygodniu podczas obserwacji, osiągając optymalne wartości w 4 tygodniu. Ge i wsp. leczyli 21 pacjentów z STC za pomocą PMK, stosując te same kryteria oceny, ponownie osiągając maksymalny poziom w 4. tygodniu, ze spadkiem skuteczności w 12. tygodniu obserwacji. W celu śledzenia długoterminowego czasu trwania PMK, Ding i wsp. przedłużyli okres obserwacji do 24 tygodni i chociaż wskaźniki remisji klinicznej w tygodniach 3-4, 9-12 i 21-24 były znacząco lepsze niż przed leczeniem, wskaźnik skuteczności stopniowo zmniejszał się od tygodnia 12, osiągając minimum w tygodniu 24. PMK jest zatem skuteczna w łagodzeniu istniejących objawów klinicznych u pacjentów z ZC i ma pozytywny wpływ na odzyskanie motoryki jelit i funkcji defekacji. PMK jest procesem remodelującym, w którym jelito gospodarza zmienia się z oporności na kolonizację na zgodność z przeszczepionymi bakteriami. Gdy przeszczepione bakterie i flora gospodarza osiągną optymalny stan wzajemnej integracji, przywracają nową równowagę flory jelitowej, przywracając jej liczebność i skład do poziomu flory zdrowego człowieka, ale z tendencją do ponownego spadku w czasie, ponieważ przeszczepione bakterie nie osiedlają się na stałe w jelicie gospodarza. Pojedynczy cykl leczenia PMK ma lepszą skuteczność krótkoterminową niż długoterminową, a 1 do 3 miesięcy wydaje się być punktem zwrotnym w utrzymywaniu się u pacjentów ZC.
Wielokrotne przeszczepy: jeden lub więcej PMK na sesję, z pewnym odstępem między sesjami. Zhang i wsp. podali łącznie 3 cykle PMK (1 raz/d przez 6 dni, powtarzając cykl po 1 i 3 miesiącach) pacjentom z ZC, przyjmując całkowitą spontaniczną defekację ≥ 3 razy jako kryterium remisji klinicznej, z tendencją spadkową wskaźników remisji od 4. tygodnia, ponownie potwierdzając wyższość skuteczności krótkoterminowej (4 tygodnie) nad długoterminową (1 rok). Ponadto u łącznie 34 pacjentów z ZC jako kryterium wyleczenia zastosowano wynik zaparcia Wexnera < 8 podczas 3 cyklów PMK (po 1 cyklu, w odstępie 3 tygodni), a także porównano wyniki 5 wizyt kontrolnych na zakończenie każdego cyklu oraz w drugim i trzecim miesiącu po ostatnim leczeniu, przy czym objawy u pacjentów poprawiły się bez istotnego odbicia, a ogólny odsetek wyleczeń klinicznych wyniósł 73,5%. Wydaje się, że wielokrotne interwencje PMK u pacjentów z ZC ułatwiają konsolidację ogólnej skuteczności, zwiększają zdolność korzystnych bakterii do przebywania w jelitach, spowalniają ich rozpad i utrzymują stopniowe tworzenie się stanu równowagi w jelitach w nowym środowisku, czyli schemat leczenia, który nieco zmniejsza utratę skuteczności. Jednak czas wielokrotnych zabiegów PMK jest nadal niejednoznaczny i potrzebne są dalsze badania, aby zmaksymalizować korzyści z interwencji PMK w celu promowania długotrwałego przetrwania korzystnych bakterii w jelitach organizmu.
Czas trwania transplantacji
Oprócz możliwego wpływu różnic w częstotliwości przeszczepów na skuteczność kliniczną, czas trwania PMK może być związany z następującymi czynnikami :
Mechanizm krótkotrwałej skuteczności jest nieznany: budowa obcych korzystnych bakterii przeszczepionych do organizmu jest końcowym wynikiem wzajemnej konkurencji pomiędzy kolonizacją i opornością, a brak jest badań nad mechanizmem najwyższej krótkotrwałej skuteczności.
Nasycenie i odrzucenie kolonizacji bakteriami kałowymi: na obecnym etapie wielokrotnych cyklów transplantacji nie skupiono się na razie na zmianach we florze jelitowej pacjentów ZC po każdym cyklu leczenia, rozważając różnice w kolonizacji i odzyskiwaniu flory jelitowej różnych osób oraz czy istnieje różnica w czasie nasycenia flory przeszczepionej między osobami bez zmiany źródła kału.
Wynik ujawniony przez użycie innego źródła kału dla każdej sesji jest otwartym pytaniem, czy późniejsza przeszczepiona społeczność tworzy konkurs odrzucenia kolonizacji przeciwko poprzedniej społeczności rezydentów.
Stosowanie antybiotyków: Pacjenci ZC po leczeniu PMK nie mogą uniknąć sytuacji, że żaden z nich nie będzie stosował antybiotyków przez krótki okres czasu, a wpływ stężenia leku przeciwdrobnoustrojowego w okrężnicy na efekt kolonizacji przeszczepionych bakterii jest niejasny na podstawie racjonalnego stosowania, a zaburzenia flory jelitowej mogą wystąpić ponownie.
Inne: Opinia konsensusu metodologicznego PMK wskazuje, że wiek, czas trwania choroby, choroby lub leki, które znacząco wpływają na florę jelitową mogą zakłócać skuteczność PMK. Ponadto, czy rodzaje ZC, metoda przeszczepu i wybór źródła kału do wielokrotnego leczenia mają statystyczne różnice w skuteczności i wpływ na homeostatyczną budowę przeszczepionej flory mają być oceniane bardziej szczegółowo, tak aby znaleźć optymalne leczenie PMK i zmniejszyć niekorzystne skutki i obciążenie ekonomiczne dla pacjentów.
Terapia łączona
Osmotyczne środki przeczyszczające są klasycznie stosowane w ZC, a połączenie z PMK daje bardziej znaczący efekt synergiczny. Liu i wsp. zastosowali PMK w połączeniu z dyspersją elektrolitów glikolu polietylenowego, a grupa eksperymentalna wykazała 30% poprawę objawów w porównaniu z grupą kontrolną. Ponadto Ge i wsp. sformułowali pektynę na bazie PMK i wyniki były również lepsze niż w grupie PMK. Połączenie PMK z lekami utrwala kolonizację przeszczepionych bakterii w jelicie gospodarza i zmniejsza ich utratę, wykazując tym samym wzrost i trwałość skuteczności.
Obecne problemy transplantacją mikrobioty jelitowej
PMK ma cechy implantacji obcego narządu na pewnym poziomie, co wiąże się z kwestiami etycznymi, jak wybrać odpowiednią florę dla mikrośrodowiska jelitowego biorcy, jak dopasować relację transplantacyjną między dawcą a biorcą, jak uniknąć reakcji odrzucenia po przeszczepie i jak skonstruować model monitorowania.
Po drugie, zwrócono uwagę na zalety i wady dróg przeszczepu, skuteczność PMK i zalety leków skojarzonych, ale brak dużej próby i prospektywnych badań klinicznych w celu wsparcia optymalnej drogi, optymalnej częstości przeszczepów i optymalnych leków skojarzonych, jak również brak konsensusu co do najlepszych wytycznych, które mogłyby je poprowadzić, w połączeniu z wieloma zewnętrznymi czynnikami wpływającymi, różnicami osobniczymi i innymi niekontrolowanymi warunkami, ponownie sprawiły, że praca kliniczna stała się większym wyzwaniem. Identyfikacja charakterystycznych zmian flory jelitowej u pacjentów z ZC i zbadanie najlepszych sposobów wdrożenia PMK nie tylko poprawi objawy kliniczne pacjentów, ale także ujednolici leczenie ZC za pomocą PMK.
Ponadto ważne jest zwiększenie świadomości społecznej na temat PMK i wyeliminowanie psychologicznych obaw pacjentów przed operacją, aby zwiększyć kliniczne zastosowanie PMK i stworzyć solidne podstawy dla bezpieczeństwa, indywidualizacji i długoterminowej skuteczności PMK w przypadku ZC.
Źródło: Jing Chen
Inne materiały
- Znakomity
- Bardzo Dobry
- Dobry
- Przeciętny
- Słaby
- Beznadziejny












Więcej
Czy ludzie agresywni powinni być izolowani i co się dzieje z ich mózgiem?
Czy Polsce grozi epidemia Ćpunów?
Ci ludzie są tak głupi a może tak mądrzy albo chorzy?